多个序列突变的筛查-HRMA(二)
突变检测
高分辨熔解曲线分析已用于DNA序列突变的检测,是第一个用于基因分型中的技术[Wittwer等,2003]。简便、廉价、容易使用、高灵敏性和高特异性是它的突出特点,使它成为一种用于基因分型和诊断应用实验室中有吸引力的新工具。在萨普,表S1给出了我们所能找到的基于人类基因的实验。高分辨熔解曲线分析系统结合功能强大的软件工具可以便利地自动分析,然而人工检测依然可用。目前,使用高分辨熔解曲线分析检测突变已经通过审查[Erali
et al.,
2008];因此,我们仅用于一般解释。此外,高分辨熔解曲线分析用于人类突变的检测已经有多篇文章发表。充分说明了其目前的发展水平(see also
Supp. Table S1)。
Tindall等[2009]对比了两种设备和荧光染料,特别是高GC含量片段DNA突变的检测。
他们说明了高分辨熔解曲线分析的限制,谨慎使用它作为临床诊断的唯一方法。Nguyen-Dumon等[2009]表明包含使用已知SNP结合稀有突变熔解探针显著减少测序的能力。Van
Der
Stoep等[2009]类似的方法设计了覆盖BRCA1基因的序列突变扫描,包括已知频率SNP的熔解探针。EuroGenTest通过多个实验室进行评估和验证HRMA作为新基因筛查的准则。在对28个失明患者的研究结果为100%的灵敏度、98%的特异性,假阳性率低。Rouleau等[2009]在同一个实验中使用一些设备完成定量PCR和HRMA去筛查核苷酸数量(缺失/重复)和质量的改变。最后,Dobrowolski
等[2009]描述了在两小时之内使用HRMA扫描16.6kb人类线粒体基因组(mtDNA)序列突变。线粒体DNA突变的识别比较复杂,因为许多是异质的,同时突变等位基因以高变化率存在。事实上,作者成功地确认在1-100%的突变存在,很好地显示了HRMA检测定量变化的灵敏度(见量化)
尽管已有报道HRMA片段达600bp或更高,但我们的实验显示该技术对小片段更灵敏。对于片段筛查,使用150-250bp片段,通常每个外显子一个片段。当实验进行的是特异突变,我们的目标片段大小是80-100bp。我们发现高灵敏度的关键是熔解图不会超过一到两个熔解区域。当片段包含了多个熔解区域,并不是所有的突变能检测出来。目前新的实验设计简化了强大的可用性设计项目,大多数情况下是和仪器一起交付。
在早期HRMA实验中可以看到两个有时甚至三个PCR产物熔解,可以提高结果。同样,特别是当DNA片段分浓度差异较大时,添加1
μL高盐缓冲液(1.0M KCL,0.5M Tris-HCL [PH=8.0])可以改善实验结果(图
2)。添加盐可以提高分辨率同时促进集群,但这种方法的成功率是不可预测的,它取决于样品、片段和突变分析。

图2.高盐的影响.A:HRMA一系列样品的分析。B:同样的样品在A分析后添加1 μL 1.0M kcl/0.5M Tris-HCl(PH=8.0)再熔解。留意分离的改善和三组图像变尖。
当一些简单的原则都考虑到时(比如,避免长片段和多重熔解域),设计一个基因的HRMA筛查非常简单。我们曾成功地设计实验筛查MDM基因第79个外显子90个片段(Al-Momani
et al)。Nguyen-Dumont 等 [2009] 和Van Der Stoep
等[2009]表明,非标记探针识别已知非致病突变时,不仅省时而且能够节约成本。防止这些片段不必要的测序,同一个片段避免忽略其它突变。
应该指出HRMA曲线的形状通常不足以区分一个特异突变[Tindall 等,
2009];完成这个实验必须添加探针或片段测序。非标记探针区分特异探针或复等位基因的能力式惊人的。图1B-D为例子(Roos
等,准备)。使用包含野生型序列的熔解探针可以区分MBL2基因中三种相近空间突变的10种可能等位基因。
最便宜的熔解探针3ˊ磷酸盐封闭可以防止PCR过程中的延伸。遗憾的是,这种探针不稳定,同时会出现不理想的额外熔解峰。其它探针较稳定但价格昂贵。Zhou等[2008]
使用snapback 引物完美的解决了这个问题,它是5ˊ端引物包含了循环区域和序列互补其延伸产物,覆盖突变筛查。
HRMA的一个缺点是对纯合子突变的检测。尽管随着目前的发展分辨率已得到很大提高 [Gundry 等.,2008],
对一些突变的差异(如A-T到T-A改变)由于变化非常小所以很容易错过。尤其是分析不同来源的样品,样品到样品的变化、实验噪音增加和微小的变化可能不能被检测到。因此,序列突变筛查应用时(临床诊断),我们坚持使用样品混合产生异源双链。首先,样品熔解得到一个标准的熔解曲线。下一步,使用图表显示(图3为DMD设计,X轴与疾病相关),混合样品同时产生第二个熔解曲线。样品混合图每个样品产生了两个杂交双链(样品很容易地自动混合)。纯合子将产生两个杂交双链,极大地提高了纯合子的检测。杂交双链将通过预混的熔解曲线检测到,尽管它们通常通过混合样品显而易见。(混合比例为1︰3)。当混合相同突变样品时,仅显示失败的样品,可以通过增加更多的控制或仅混合不相关的样品可以简单地预防
。必须指出 体系的存在可以从真正的纯合子等位基因区分半合子。

图3.生成异源双链。为了确保纯合子突变的检测,可以使用显示的方案。板孔1-12包含每个样品(患者A-F和wt=wild-type控制)不同片段(外显子)的PCR产物。第八排为空。从第一个从第七排(wt,5-10
μL
PCR产物)样品的一半HRMA混合开始,然后转向第八排。随后,第六排一半量转向第七排,第五排一半转向第六排等等等。最后,第八排转向第一排,然后片段再次熔解。
应当指出,HRMA检测杂合子的灵敏度高于DNA测序。因此,当HRMA显示突变存在,而测序不能确认时。可能是这个突变存在也样品相对小的片段(体细胞嵌合体)。其它技术:如,克隆+测序或单分子稀释+PCR和HRMA,可以确认这些突变。
-
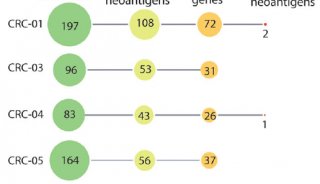
项目成果
-
项目成果

-
焦点事件

-
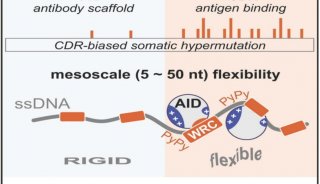
焦点事件
-
科技前沿

-
焦点事件

-
企业风采

-
焦点事件

-
科技前沿

-
科技前沿
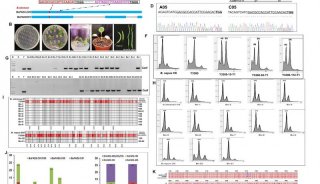
-
科技前沿

-
项目成果
-
项目成果
-
项目成果

-
产品技术

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采
-
焦点事件

-
焦点事件

-
科技前沿