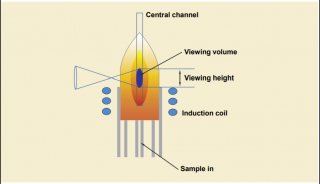
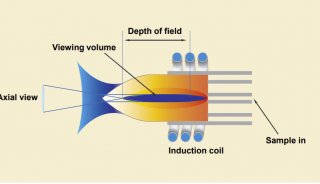
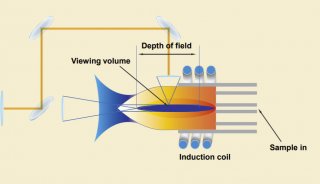
双向电泳操作步骤
双向电泳操作步骤
第一向凝胶
第二向凝胶
组织来源的蛋白质样品的溶解和制备
| 实验方法原理 | 双向电泳(two-dimensional electrophoresis)是等电聚焦电泳和SDS-PAGE的组合,即先进行等电聚焦电泳(按照pI分离),然后再进行SDS-PAGE(按照分子大小),经染色得到的电泳图是个二维分布的蛋白质图。 |
|---|---|
| 实验材料 | 细胞样品 |
| 试剂、试剂盒 | ddH2O 溴酚蓝指示剂 矿物油 丙烯酰胺 乙醇 MilliQ 水饱和正丁醇 SDS 琼脂糖 |
| 仪器、耗材 | 样品水化盘 冰箱 厚滤纸 摇床 电泳槽 电泳仪 镊子 二向电泳制冷仪 手套 |
| 实验步骤 |
一、样品制备。 1. 称重后将样品加入Dounch匀浆器。每100 mg 组织加入1.5——2.0 ml SDS/或尿素/溶解缓冲液,用B号研棒冲击50次,然后以A号研棒冲击50次。 2. 放置几分钟后,取一小份样品于200 μl 离心管100 000 g 离心2 h 以上或在200 000 g 以上离心1 h。保留上清(蛋白样品)。加样于第1向凝胶上。 二、第一向等电聚焦。 1. 在干净的1.5 mm 内径的凝胶柱管上作好标记以指示应灌制凝胶柱的髙度。用橡皮筋将凝胶柱管捆绑成束,在一水平面上垂直竖起管束,从其顶部向下推压,使各柱管的底部平齐。 2. 用三、四层Parafilm膜小心封好2.5——3.0 cm 内径的凝胶灌制管的一端,使之形成一个结实的水密性的密封面。 3. 将凝胶柱管束放入凝校灌制管内,用环形支架和夹子将灌制管固定在垂直的位置,并使其密封端置于一水平面之上。 4. 加8.25 g 尿素、6.0 ml 水、2.0 ml 30%丙烯酰胺/1.8%亚甲双丙烯酰胺、0.75 ml pH4——8的Ampholytes 两性电解质于一个小的真空瓶中。瓶内加一小搅棒,将瓶子置于磁力搅拌器的温水浴中,搅拌至尿素全溶于水,不要加热使溶液温度超过30℃。 5. 在强真空下脱气2——3 min,加入0.3 ml NP-40,摇晃使之溶解混匀。 6. 将溶液倒入带0.2或0.45 μm 针头式滤器的注射器中,推压使之通过滤器。加入10 μl TEMED,摇匀;再加70 μl 过硫酸铵,摇匀。立即用吸管将溶液加入到凝胶柱管和大的凝胶灌制管之间的空间。 7. 用一洗瓶轻轻地在凝胶往管的外面加入水,直至将丙烯酰胺溶液压进拄管至所设定的高度,放置使凝胶聚合。 8. 取去凝胶灌制管底部的Parafilm膜从底部将含有聚合好凝胶的凝胶管推出,用单刃刀片切去管子底部多余的丙烯酰胺。并在流动的去离子水下冲洗,除去残余的丙烯酰胺。 9. 在每根管子的顶部套上橡皮扣眼,留意在扣眼下仍可看见凝胶的顶部,在扣眼上需留约5 mm 凝胶管。 10. 将凝胶管连同扣眼安装在上缓冲液槽的孔眼中,多余的孔眼用橡皮塞子堵紧。 11. 往下缓冲液槽加入大约3 L 0.085%的磷酸。 12. 将上、下缓冲液槽安放在一起,调整下缓冲液槽使液面盖没凝胶。 13. 上缓冲液槽加入250 ml 0.02 mol/l 的NaOH,用带22G皮下针头的1 ml注射器将凝胶管的顶部用0.02 mol/l 的NaOH充满,小心排去凝胶管中的所有气泡。 14. 连接电源,黑色的导线接于上槽。在200 V 恒压下预聚集1 h 撤开电泳槽与电源的连接。 15. 用50 ml 注射器将10——30 μl 蛋白质样品穿过凝胶管上的缓冲液直接加在凝胶的表面。 16. 盖上上槽盖后,连接电源。打开电源调到设定电压,恒压电泳16 h。 17. 将电压调到零位,关闭电源,结束电泳。用50 μl 注射器往毎根凝胶的顶部加入约1 μl 浓溴酚蓝溶液。 18. 用一个装上了 200 μl 移液器的吸头的注射器,将凝胶用水压从凝胶管中挤出。 19. 将凝胶放入作好标记的小瓶中,凝胶可立即使用或在-70℃放置数周。 20. 凝胶管在铬酸冼液中浸泡过夜,在流动的去离子水中冲冼15 min。吸干管子中多余的水分,使之干燥。 三、第二向SDS电泳。 1. 用垫片组装凝胶平板。夹层每边的垫片之上用夹子固定,并置于凝胶支架上。注意玻璃平板和垫片的平齐,收紧夹子以保证密封圈不发生泄漏。调整平板的水平和垂直,在平板间将放上凝胶识别标签,使之留在右下角。 2. 在一个真空瓶中分别加入30%丙烯酰胺/0.8%亚甲双丙烯酰胺,凝胶缓冲液和水,配制凝胶溶液。真空下脱气5 min。 3. 加入10%SDS和TEMED,摇匀;再加入10%过硫酸铵,摇匀。 4. 加入溶液于凝胶夹层中,加至离短的玻璃平板顶部5 mm 处,上面加一层水饱和异丁 醇或水,使凝胶聚合1.5 h。 5. 入平衡缓冲液完全覆盖第1向凝胶。 6. 将凝胶连同平衡缓冲液一起倒于一个置于一烧杯之上的尼龙网筛上,然后将凝胶移于一 5 cm ×15 cm 的玻璃平板上,用小铲将凝胶沿凝胶夹层的一边放好。 7. 用吸管往将要加样的平板凝胶的顶部加一很薄的热的0.5%琼脂糖。 8. 用小铲小心地将第1向凝胶滑到玻璃平板并横跨于平扳凝胶的顶部,第1向凝胶蓝染的一端靠右。 9. 往第1向凝胶上加一层热的0.5%琼脂糖,让琼脂糖固化并将凝胶固定。 10. 将凝胶夹层安置于电泳槽中。往上、下槽加入预冷的电泳缓冲液。 11. 用管子将冷却剂的入口和出口连好,开始让冷却剂流动,使电泳槽中缓冲液的温度保持在10——20℃,保证电泳过程中凝胶得到充分的冷却。 12. 用导线将电泳室与电猓连接,每片凝胶在15——20 mA的电流下电泳至指示染料到达凝胶的底部。 13. 在电泳结束时将电压调至零位,关闭电源。从电泳单元中取出凝胶夹层,并取走夹子。 用小铲将玻璃平板橇起。 四、凝胶的染色。 五、凝胶扫描和分析。 。 展开 |
| 注意事项 |
在离心前,样品在SDS/溶解缓冲液中煮沸5 min,千万不要在尿素/溶解缓冲液中加热样品。在第1向电泳前离心样品。
|
| 其他 |
常见问题: 1.重泡胀后的胶可以不用转移到另一个电泳槽,直接跑 2D 的一向吗? 一般情况下是可以的。但当上样量特别大时,可能会有一部分蛋白质没有被胶条吸收,这样跑完 1D 和 2D 胶后,会有很多横向条纹。所以在这种情况下,最好在重泡胀后,将胶条转移到另外一个电泳漕中进行电泳。 2.为什么我在等电聚焦前加的矿物油在聚焦后会减少,暴露出了胶条的背面? 通常情况下,等点聚焦中体系内除了蛋白质还会存在少量带电小分子,当这些带电小分子在电场中向两极运动时,会带动胶条中的水分子运动,水分子运动会带动附近的覆盖油移动,当样品质量不高,带电小分子较多时,会导致覆盖油移动严重溢出胶条槽,此时,通常会伴随胶条的酸性端胶条厚度增加。当发生覆盖油溢出或胶条暴露时,应及时补加覆盖油。为了防止这个现象的发生,应从样品制备时严格控制样品质量,尽量减少带电小分子如盐离子的含量。同时可以在相邻的空电泳槽里,也加入适量(80 %满)的覆盖油。 3.跑第一向时,为什么要设定一个电流的最大值电压(50 μ A/ 胶)? 电流的平方和功率成正比。电流增大,功率增大,放出的热量也随之增大,就会导致胶条的温度增加。当温度超过 30 摄氏度时,缓冲液里的尿素就容易解离,产生一些极性分子,修饰蛋白,从而对等电聚焦产生影响。 4.跑第一向时,为什么刚开始的电压比较低,而后逐渐增高? 刚开始时,体系内的带电小分子比较多(比如无机盐和双极性分子)。所以在这个阶段,电流主要是由这些小分子的移动所产生的。由于这些分子质量小,移动他们不需要很高的电压。当这些小分子移动到他们的目的地时(无机盐移动到极性相反的电极;两性分子移动到对应的 pH 条带),体系内的蛋白质才开始肩负起运载电流的任务,逐渐向所对应的 pH 区域移动,而蛋白质运动需要较高的电压。 5.跑第一向时,为什么会产生一条蓝色的条带,并逐渐向酸性端移动? 蓝色条带是缓冲液中痕量的溴酚蓝被聚焦所产生的。溴酚蓝也是 pH 指示剂,当它移动到酸性区时(pH4),颜色会变成黄色。溴酚蓝的这个移动过程大体上发生在极性小分子的聚焦之后,蛋白质大分子聚焦之前。 6.跑第一向时,为什么电压总达不到预定值? 当上样量比较大时或体系内盐分比较多时,聚焦的电压有可能达不到所设定的数值。 跑第一向时,在电压达到预定值后,电流为什么会降低? 当上样量比较少时,所有蛋白在较短的时间内就移动到所对应的 pH 值区域值,从而变成中性分子。这样,体系的电阻越来越大,在恒定的电压下,电流就会越来越小。 7.跑第一向时,为什么在两个电极丝附近有气泡产生? 等电聚焦完成后,所有的蛋白质都移动到了相应的 pI 值区域,而成为中性分子。这时加在体系上的电压就开始电解水分子,在阳极产生氧气,在阴极产生氢气。 8.重泡胀缓冲液(rehydration buffer)中的硫脲的作用是什么,双极性分子的作用是什么? 硫脲的作用是增加蛋白质的溶解性,特别是碱性蛋白的溶解性。双极性分子的作用也是增加蛋白质的溶解性。当蛋白移动到相应的 pH 值后,就变成了中性分子。而不带电荷的蛋白质分子容易聚集,从而降低其在随后的二向胶时的迁移效率,可能会造成竖的脱尾。而硫脲和双极性小分子则会鉴定中性蛋白质之间的相互作用,防止它们的聚集。 9.怎样估计 2D 胶上蛋白质点的分子量和 pI 值? 可以根据胶条的pH范围和长度估算蛋白质点的pI值,在第二向中加入分子量Marker估算蛋白质点分子量。也可以用体系内已知蛋白来做比对。 10.为什么 2D 胶上的蛋白点有横的和竖的脱尾? 横的脱尾可能是:1)一向等电聚焦不完全; 2)某些蛋白质本身的原因(糖蛋白); 3)蛋白的丰度太高。竖的脱尾可能是1)平衡时碘乙酰胺量不足;2)跑二向时,蛋白的溶解度不好。 11.什么成分会影响 2D 胶的效果? 核酸,盐,去垢剂等等。 12.2D 胶的上样量应该在什么范围? 上样量和样品有关。样品内蛋白种类多的上样量要大些,这样每个点才有足够的量被检测到。一般的全细胞裂解体系,上样量大概在 100 微克(银染)到 500 微克(考染)之间。 13.我的蛋白质浓度很低,应该用什么方法来浓缩? 蛋白质的浓缩有很多方法。大致有超滤法,沉淀法和透析法。超滤比较温和,对蛋白质不会有修饰和改变,蛋白的种类一般不会有丢失。它的缺点是总样品的量可能会减少(被膜所吸附)。另外超滤对样品的要求比较高。甘油,去垢剂都会堵塞滤膜,影响超滤的效果。沉淀法比较快速,容易操作,对盐,甘油,去垢剂的耐受性好。缺点是可能会有部分种类的蛋白没有被沉淀下来(丢失)。沉淀法中,又以 TCA 法最为普遍使用。使用 TCA 法时,一定要用冷的纯丙酮清洗蛋白沉淀两次,去处残留的 TCA 和其他沉淀下来的杂质。透析法只使用于量比较大的样品,量小时,操作困难。透析法可以和超滤法联用。先把样品透析到一个比较干净的环境(不含盐,甘油,去垢剂或其它杂质,比如碳酸氢氨溶液),然后再进行超滤。
展开 |
-
科技前沿
-
综述
-
技术原理
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
技术原理

-
科技前沿