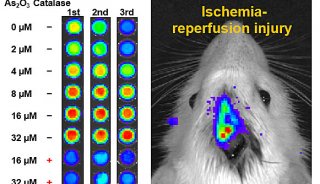
胚胎中细胞基因打靶方法
胚胎中细胞基因打靶方法
置换型设计物的制备
1.选择靶基因的一个部分作为设计物的组成,还包括有靶基因的另一个部分作为Southern杂交探针,以鉴定细胞中是否已发生同源重组之用。
2.在质粒载体中构建一个克隆;neo基因能阻断靶基因的表达,在neo的两侧保持保留同源区;在同源区外的置换型设计物中包含一个胸腺嘧啶激酶(TK)基因。
3.用限制性内切酶消化设计物DNA使成线形;设计物DNA线形化后,质粒DNA仍附于在TK基因上。如果设计物在基因组发生随机插入中出现任何DNA序列丢失时,线性态有助于保持TK基因的活性。
4.用酚/氯仿抽提设计物DNA。
5.用加两个体积的95%乙醇沉淀,微型离心机离心30秒,去上清,使沉淀物干燥到仍保持微湿润状态。
6.把沉淀物溶于100μl水中,检测是否已被彻底消化,在凝胶电泳中测定DNA的浓度。
转染设计物和ES细胞的选择
7.把细胞培养在ES/LIF培养基中;每2~3天传代细胞,把细胞接种到100mm凝胶培养皿上,每皿1~2×106细胞。
8.用胰蛋白酶/EDTA消化收集细胞达5×106~1×107;消化5分钟,令细胞完全脱壁,用吸管吹打使分散成单细胞,加5ml ES培养液,用1ml电击液重悬于同一管中。
9.加1 pmol消毒线性DNA。
10. 450V,250μF在4mm电击小室中进行电击;室温中培养10分钟。
11. 把ES细胞培养在ES培养液中,按1~2×106细胞/100mm凝胶培养皿上,培养24小时。
12. 更换入含有G418(2mg/ml终浓度)和GANC(2μM终浓度)的ES/LIF培养液中,进行筛选。
13. 继续培养,每日更换一次ES/LIF培养液和加有G418(2mg/ml终浓度)及GANC(2μM终浓度),继续筛选直到单个、分离的克隆出现为止(典型情况下,电击后1周内出现);用一个高压消毒过的吸管从培养皿中分离出单个克隆,置入35μl胰蛋白酶/EDTA液中消化5分钟;反复吹打5次分散细胞,把细胞转入铺有凝胶和每孔含有1ml ES/LIF培养液24孔培养板中。
14. 培养至克隆出现,但细胞无分化(3~4天);半数细胞传代铺有凝胶24孔板中监视,把剩余的细胞加入到0.5ml冻存培养液中,-70℃过夜,次日转入液氮中。
15. 监视ES细胞,在24孔培养板中培养至接近汇合(通常2~3天);在此阶段中对防止ES细胞发生分化并非十分严格,在培养液中也可不加LIF,但在LIF存在情况下,利于对细胞的生长。
16. 加300μl消化缓冲液,转入1.5μl微型离心管中,在55℃中培养过夜。
17. 加150μl饱和NaCl,强烈旋转。加2体积的95%乙醇。有一些学者用两体积的乙醇沉淀DNA但不加盐。
18. 把DNA沉淀重悬入50μl水中,OD260吸收值测DNA浓度。
19. 消化10μg DNA,再加适当内切酶酶解。
20. 把消化的DNA走1%琼脂糖凝胶电泳,把不同长度的DNA片段分离开,转移到尼龙膜上,做Southern吸印转移,选用从步骤1中的探针进行杂交,把无改变的靶基因,从已发生同源重组的靶基因中区分出来。
21. 筛选ES细胞,显示有两个近于相同强度的杂交片段;一个应为无改变的靶基因,另个应为发生同源重组的靶基因。如果两个片段显示呈现不同杂交强度,则细胞群可能不是克隆群。细胞冻存于液氮中。
-
项目成果
-
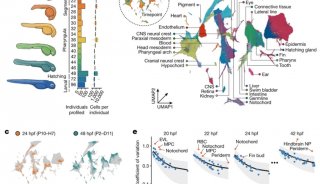
项目成果
-
综述

-
科技前沿
-
技术原理

-
产品技术

-
焦点事件

-
综述

-
焦点事件

-
综述
-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果