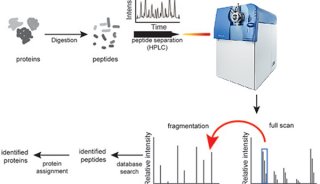
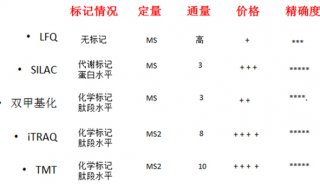
醋酸纤维薄膜电泳分离血清蛋白质实验方法(一)
实验原理
带电荷的蛋白质,在电场中向着与其所带电荷电性相反的电极泳动称为电泳。血清中各种蛋白质的等电点不同,但大都在pH7以下,若将血清置于pH8.6的缓冲液中,则这些蛋白质均带负电,在电场中都向阳极移动。由于各种蛋白质在同一pH环境中所带负电荷多少及分子大小不同,所以在电场中向阳极泳动速度也不同。蛋白质分子小而带电荷多者,泳动速度快;反之,则泳动速度慢。因此可将血清蛋白质依次分为清蛋白、a1-球蛋白、a2-球蛋白、b-球蛋白和g球蛋白五条区带,经染色可计算出各血清蛋白质含量的百分数。
以醋酸纤维薄膜(CAM)为支持介质,电泳分离后经染色处理,可展示出清晰的蛋白质电泳图谱。由于染色时染料与蛋白质的结合与蛋白质的量成正比,因此将各蛋白质带剪下,分别用一定量的NaOH稀溶液洗脱下来,即可进行比色,测定出各蛋白质区带的相对含量。也可用一定量的有机溶剂使CAM溶解制成透明膜而用光密度计进行扫描定量。
醋酸纤维薄膜电泳具有微量、快速、简便及分辨率较高等优点,广泛应用于血清蛋白、血红蛋白、脂蛋白、同工酶的分离和测定。
实验试剂
1.巴比妥—巴比妥钠缓冲液(pH8.6,m=0.06)。称取巴比妥2.21克和巴比妥钠12.36克,溶于500毫升蒸馏水中,加热溶解。待冷至室温后,再加蒸馏水稀释至1000毫升。
2.染色液
(1)丽春红S染色液:称取丽春红S O.4g、三氯醋酸6g,用蒸溜水溶解并稀释至100ml。
(2)氨基黑10B染色液:称取氨基黑(C22H13O12N6S3Na3)10B 0.1g,溶于20ml无水乙醇中,加冰醋酸5ml,使其溶解。另取磺基水杨酸2.5g,溶于少量的蒸馏水中,加入前液将两液混合摇匀,再以蒸馏水补足至100ml。称取丽春红S0.4克及三氯醋酸6克;用蒸馏水溶解,并稀释至100毫升。
3.漂洗液。
(1)3%(V/V)醋酸溶液:适用于丽春红S染色的漂洗。
(2)甲醇45ml、冰醋酸5ml、蒸馏水50ml混匀,适用于氨基黑10B染色的漂洗。
4.透明液 取无水乙醇75毫升和冰醋酸25毫升混匀备用。
5.洗脱液
(1)0.1mol/L NaOH溶液:用于丽春红S染色的洗脱。
(2)0.4mol/L NaOH溶液:用于氨基黑10B染色的洗脱。
6.40%(V/V)醋酸溶液。
实验设备 电泳仪、电泳槽、分光光度计或光密度仪。
实验材料 醋酸纤维薄膜、培养皿、滤纸、镊子、点样器、直尺、铅笔、剪刀等。
实验步骤
1、电泳槽的准备
将巴比妥-巴比妥钠缓冲液加入电泳槽中(两侧槽内注入等量的缓冲液),调节两侧内的缓冲液,使其在同一水平面,液面与支架的距离约为2~2.5cm。支架宽度到恰好适合CAM的长度,用3~4层滤纸或4层纱布搭桥。
2、CAM准备
取醋纤薄膜(2厘米*8厘米)在CAM的无光泽面(涂有醋酸纤维素)距一端1.5cm处用直尺和铅笔轻划一线(与CAM的长轴垂直),作点样标记,将膜条编号后将无光泽面朝下浸入巴比妥-巴比妥钠缓冲液中,待充分浸透后取出(一般约需求20~30min),夹于洁净的滤纸中,吸去多余的缓冲液。
3、点样
用血清加样器将3-5ul无溶血的新鲜血清均匀地点在划线处,样品应与膜的边缘保持一定距离,以免电泳图谱中的蛋白区带变形。待血清渗入膜后移开点样器。点样应注意,要适量、均匀和垂直,并避免弄破薄膜。
4、平衡
将已点样的薄膜加样面朝下,点样端置于阴极端,将膜条紧贴于电泳槽支架的盐桥上并保持平直,桥的另一端垂入缓冲液中,盐桥将膜的两端与缓冲液连通,加上槽盖平衡5min后通电电泳。
5、电泳
正确联接电泳槽与整流器对应的正负极,点样侧接负极,另一侧接正极。开启电源通电。调节电压10V~15V/cm膜长,电流0.4~0.6mA/cm膜总宽,电泳40-60分钟(通常夏季需45min,冬季需60min),待电泳区带展开3.5cm~4cm时即可关闭电源。
-
企业风采

-
焦点事件

-
综述
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件