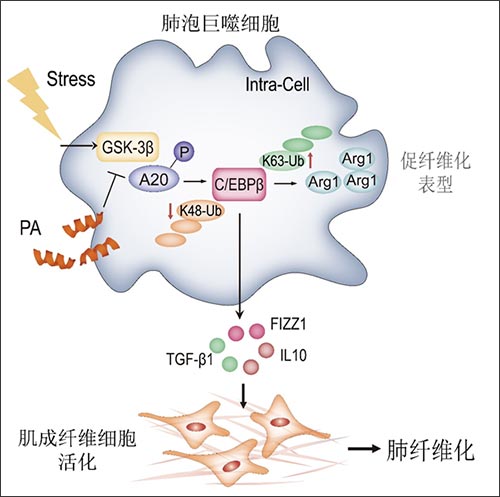
A20酶活性通过促进转录因子C/EBPβ降解抑制肺纤维化
肺纤维化严重影响呼吸功能,表现为干咳、进行性呼吸困难(自觉气不够用),且随着病情和肺部损伤的加重,患者呼吸功能不断恶化。特发性肺纤维化发病率和死亡率逐年增加,诊断后的平均生存期仅2.8年,死亡率高于大多数肿瘤,被称为一种“类肿瘤疾病”。
科学家们认为,肺纤维化既是独立疾病,也是慢性纤维增生性肺病的基本病理改变,而且更重要的是,目前没有真正能够逆转肺纤维化的药物。
来自中国医学科学院药物研究所的研究人员发表了题为“Targeting the Transcriptional Factor C/EBPβ Degradation Reduces Lung Fibrosis by Restoring Activity of the Ubiquitin-Editing Enzyme A20 in Macrophages”的文章,在肺纤维化发病的分子机制研究方面取得重要进展。
这一研究成果公布在Cell出版社旗下Immunity杂志上,文章的通讯作者为中国医学科学院药物研究所胡卓伟研究员,助理研究员刘姗姗和吕晓希作为该论文的共同第一作者,对本研究做出了主要贡献。
胡卓伟研究组主要致力于从免疫学角度研究肺纤维化发病的分子细胞生物学机制,在此基础上研发能够预防和治疗肺纤维化的药物。近年来也取得了不少成果,而最新这项研究发现了恢复泛素编辑酶A20如何促进肺泡巨噬细胞向促纤维化表型的转化的过程。
图1. GSK-3β与A20相互作用导致A20酶活性的抑制,引起其底物C/EBPβ大量堆积和巨噬细胞促纤维化表型转化,促进肺纤维化发病
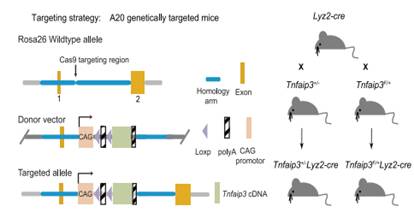
研究人员通过TNFAIP 3+/-Lyz2-cre和Tnfaip3F/+Lyz2-cre小鼠(图2),提高或降低肺泡巨噬细胞中A20的表达,来确定A20在肺纤维化发展中的作用。(研究中所用的TNFAIP 3+/-小鼠由赛业生物构建)。机制研究发现,A20活性的抑制介导了肺泡巨噬细胞向促纤维化表型的转化,巨噬细胞中转录因子C/EBPβ是A20的泛素化修饰底物,A20通过去掉K63泛素化修饰链,增加K48泛素化修饰链,促进C/EBPβ的降解,而肺纤维化时A20活性的抑制导致肺泡巨噬细胞中C/EBPβ大量堆积,促进肺泡巨噬细胞向促纤维化表型的转化。
图2. TNFAIP 3+/-小鼠的打靶策略及TNFAIP 3+/-Lyz2-cre和Tnfaip3F/+Lyz2-cre小鼠的制备。
此外,研究人员还发现在肺纤维化组织中高表达的GSK3β导致A20的磷酸化,抑制A20的酶活性,促进巨噬细胞的活化。这些结果提示GSK3β-A20-C/EBPβ轴是导致肺纤维化组织中肺泡巨噬细胞活化的重要原因,而GSK3β/A20相互作用是治疗肺纤维化的重要靶点。
在此基础上,研究人员通过分析GSK3β与A20相互作用结构域氨基酸序列,筛选到可以抑制GSK3β和A20结合的小分子多肽探针。随后该研究团队证实该干扰肽在不同肺纤维化模型中均产生很好的治疗效果。
这项研究从全新角度阐释了肺纤维化发病的分子机制,不但鉴定和发现了GSK3β/A20相互作用这一纤维化治疗的潜在新靶点,更发现了靶向该相互作用的治疗性多肽,展现了分子机制研究向临床应用转化的潜力。
-
产品技术

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件