李凌衡课题组发现造血干细胞骨髓微环境调控新机制
造血干细胞(HSC)微环境对HSC的功能维持和损伤修复有至关重要的调控作用。然而由于骨髓微环境构成的复杂性,HSC骨髓微环境的研究领域一直存在众多争议。美国Stowers研究所李凌衡及David Scadden两课题组最早发现骨内膜区域的成骨(或其前体)细胞【1, 2】,Sean Morrison 和Paul Frenett两课题组随后发现大量的HSC定位在骨髓内不而不是骨内膜区域,并且多个课题组的研究表明骨髓中央的血管、神经、间充质干细胞甚至成熟的血液细胞如巨核细胞【3】都可以作为HSC的微环境对其发挥调控作用【4, 5】。然而众多的骨髓微环境细胞如何对HSC进行功能调控还不清楚:不同的骨髓微环境细胞很可能调控了不同的HSC亚群【6-8】。

李凌衡教授在2018年深圳华人生物学家大会
1月15日,Cell Reports杂志发表了美国Stowers研究所李凌衡课题组的论文,题为N-cadherin-Expressing Bone and Marrow Stromal Progenitor Cells Maintain Reserve Hematopoietic Stem Cells(https://doi.org/10.1016/j.celrep.2018.12.093)。在这项最新的研究中,研究团队解析了不同HSC亚群的微环境调控机制。
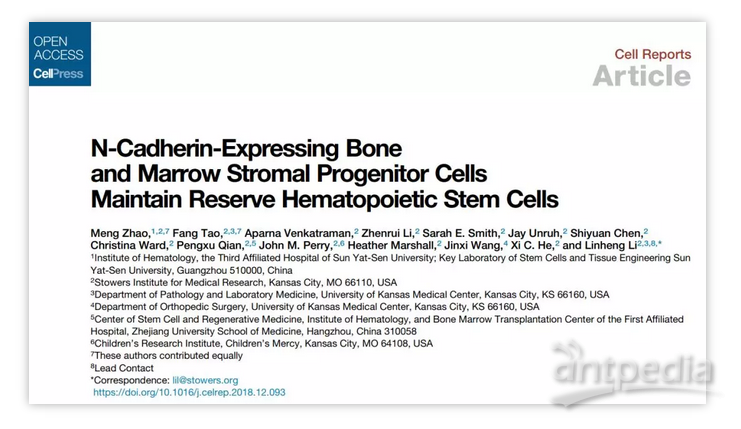
本研究首先通过表面分子标记物的筛选结合骨髓移植等功能实验发现了两种不同的HSC功能亚群,数量上占少数的Reserve (储备) HSC (rHSC) 亚群和占多数的Primed (激活前态) HSC (pHSC )亚群。虽然rHSC和pHSC都有正常的造血功能,在骨髓移植模型中可以支持小鼠造血40周以上,然而rHSC可以产生出pHSC,pHSC却很少产生rHSC。团队进一步发现rHSC对化疗药物有更强的抗性:在化疗刺激下大量的pHSC死亡,而rHSC却可以存活下来进一步产生出pHSC,完成血液系统的损伤修复。
研究团队发现rHSC和pHSC在骨髓中定位于不同的微环境区域: 占大多数的pHSC定位骨髓中的血管微环境,而且rHSC更倾向于定位在骨内膜区域,特别是靠近表达N-cadherin的间质细胞。表达N-cadherin的细胞是最早发现的HSC微环境细胞【1】,但其细胞特性一直不清楚。
研究团队通过N-cadherin的荧光报告小鼠和谱系追踪等体内实验,首次证明了N-cadherin表达的细胞为具有成骨、软骨和脂肪分化能力的间充质(或骨骼)干细胞,并且通过条件性敲除小鼠模型证明,表达N-cadherin的骨髓间充质细胞通过分泌SCF等因子来维持rHSC的干性,特别是对rHSC在化疗损伤后的修复起重要作用。
此项研究为理解骨髓微环境构成的复杂性奠定了基础:HSC骨髓复杂的微环境构成可能来源于不同的HSC功能亚群对不同的微环境信号的需求。该论文将有助于解决关于造血干细胞的微环境的长期争论。
正如古印度盲人摸象的故事:综合来说,早期骨内表面造血干细胞的微环境假说以及后期血管周边细胞造血干细胞的微环境假说如同触及了部分象身,得到了部分正确的结论; 而本研究全面阐述并总结了不同骨髓微环境细胞群(Niche),从而得到“全象”信息。 正常情况下,由血管周边细胞造血干细胞微环境维持的pHSCs起主要作用; 但在应急情况下,诸如化疗,放疗,炎症引起血液以及造血细胞(包括pHSCs)大量缺失,位于骨表面的rHSCs将在应急情况下干细胞群恢复和随后的造血系统重建起主要作用。
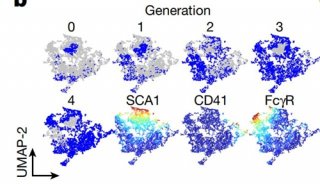
在细胞水平,无论是位于血管周边的Nestin, LepR, 或 CAR阳性细胞, 还是骨表面N-cadherin阳性细胞都有间充质干细胞或骨骼干细胞的特性。而且,由N-cadherin诱导的谱系追踪,可检测到Nestin, LepR, 或 CAR阳性细胞。
所有这些关于造血干细胞的微环境(Niche)的研究将为其它,例如仍处于相对早期研究阶段的肠道干细胞Niche的研究,提供有启发性的先例。另外,我们还发现N-cadherin阳性细胞不仅在小鼠,而且在人体中,也具有间充质干细胞或骨骼干细胞的特性: 即可产生成骨细胞和软骨细胞。 因此N-cadherin可作为标记,用来有效地分离和鉴定间充质干细胞或骨骼干细胞,在骨和软骨的再生医学中将会有广泛的应用。

图为李凌衡教授在2018年深圳华人生物学家大会上干细胞分会场做造血干细胞骨髓微环境调控报告
据悉,作为共同第一作者的赵萌和陶芳分别对区分rHSC和pHSC亚群以及证明N-cadherin表达的间充质细胞为具有成骨、软骨和脂肪分化能力的间充质(或骨骼)干细胞作出重要贡献(详细请见后面介绍)。何曦对N-cadherin的功能研究有重要贡献。Aparna Venkatraman对不同Niche细胞进行了表达图谱分析。堪萨斯大学的王进喜教授指导了陶芳证明N-cadherin阳性细胞向软骨分化的潜能。
参考文献
1. Zhang J, Niu C, Ye L, Huang H, He X, Tong WG, et al. Identification of the haematopoietic stem cell niche and control of the niche size. Nature. 2003;425(6960):836-41.
2. Calvi LM, Adams GB, Weibrecht KW, Weber JM, Olson DP, Knight MC, et al. Osteoblastic cells regulate the haematopoietic stem cell niche. Nature. 2003;425(6960):841-6.
3. Zhao M, Perry JM, Marshall H, Venkatraman A, Qian P, He XC, et al. Megakaryocytes maintain homeostatic quiescence and promote post-injury regeneration of hematopoietic stem cells. Nat Med. 2014;20(11):1321-6.
4. Wei Q, and Frenette PS. Niches for Hematopoietic Stem Cells and Their Progeny. Immunity. 2018;48(4):632-48.
5. Morrison SJ, and Scadden DT. The bone marrow niche for haematopoietic stem cells. Nature. 2014;505(7483):327-34.
6. Pinho S, Marchand T, Yang E, Wei Q, Nerlov C, and Frenette PS. Lineage-Biased Hematopoietic Stem Cells Are Regulated by Distinct Niches. Dev Cell. 2018.
7. Jiang L, Han X, Wang J, Wang C, Sun X, Xie J, et al. SHP-1 regulates hematopoietic stem cell quiescence by coordinating TGF-beta signaling. The Journal of experimental medicine. 2018.
8. Itkin T, Gur-Cohen S, Spencer JA, Schajnovitz A, Ramasamy SK, Kusumbe AP, et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 2016;532(7599):323-8.
-
企业风采

-
精英视角

-
企业风采

-
焦点事件

-
精英视角

-
项目成果
-
项目成果

-
焦点事件

-
项目成果
-
焦点事件

-
企业风采

-
企业风采

-
企业风采

-
项目成果
-
科技前沿
-
科技前沿

-
焦点事件

-
项目成果

-
科技前沿

-
科技前沿

-
综述

-
项目成果

-
焦点事件

-
项目成果
-
企业风采

-
综述

-
综述

-
综述

-
会议会展

-
项目成果
-
技术原理
-
项目成果
-
精英视角

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件

-
项目成果

-
项目成果
-
项目成果
-
焦点事件