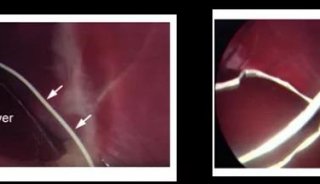
用于激酶分析的细胞裂解实验
| 实验材料 | |
|---|---|
| 试剂、试剂盒 | |
| 仪器、耗材 | |
| 实验步骤 | 1. 用预冷的 PBS 洗细胞 2 次,将最后的洗液尽可能吸尽。 2. 加入 0.75 ml 裂解缓冲液重悬 2 × 107 个细胞,若是贴壁细胞必须完全覆盖。加入蛋白酶抑制剂储存液,使其终浓度为 1 mmol/L PMSF,100 μmol/L 苯甲脒,5 μg/ml 亮抑蛋白酶肽,5 μg/ml抑胃酶肽 A,5 μg/ml抗蛋白酶。 3. 4°C 冰浴细胞 10 min,刮离细胞并将裂解液移至标记的微量离心管中。 4. 4°C,最大速度离心 10 min,小心地将上清移至新微量离心管中,迅速进行后续实验。 |
| 注意事项 | 若用于免疫沉淀(先使用 25%~50% 的裂解物进行初试验,再依据结果进行裂解物量的调整)和简单纯化,0.75 μl 的裂解物就足够了。如果纯化过程需经超过一次以上的层析步骤。可适当扩大裂解液的量,因为每一层析步骤仅能回收 10%~20% 的激酶活性。 |
推荐
-
产品技术

-
产品技术

-
焦点事件

-
企业风采

-
项目成果

-
技术原理
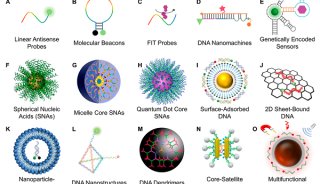
-
企业风采

-
技术原理
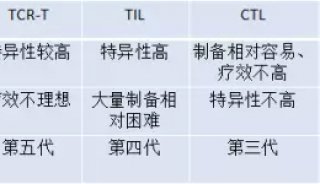
-
技术原理
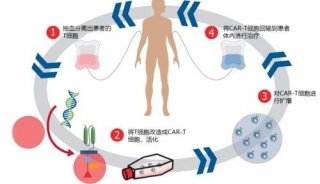
-
焦点事件

-
综述
-
企业风采