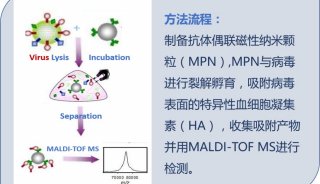
痘苗病毒系统基因表达实验(一)
本节介绍依赖于在哺乳动物细胞质合成噬菌体 T7 RNA 聚合酶的瞬时细胞质表达系统。首先,将感兴趣的基因插入质粒中,使其位于 T7 RNA 聚合酶启动子(PT7)的控制下。应用脂质体转染,重组质粒进入感染了 vTF7-3 的细胞质中,而 vTF7-3 是一种能编码噬菌体T7 RNA聚合酶的重组痘苗病毒(见「重组痘苗病毒(VTF7-3)感染后的脂质体转染」)。在培养过程中,外源基因被高效的 T7 RNA 聚合酶转录。这种转染方案适用于分析的目的,因为不需要构建新的重组病毒,所以比较简单。
对于大规模的工作,PT7 操纵的基因可以通过同源重组插入另一个重组痘苗病毒中,使之与 vTF7-3 共同感染悬浮细胞(见「两种重组痘苗病毒共感染细胞」)表达的蛋白质可以用脉冲标记的方法或用「重组痘苗病毒及其产物的鉴定实验」中叙述的方法分析鉴定,用「离子交换层析实验」描述的方法纯化。
重组痘苗病毒(VTF7-3)感染后的脂质体转染
| 实验方法原理 | 本方案从构建外源基因位于 PT7 和 T7 终止子之间的质粒载体开始,然后用重组质粒通过脂质体介导转染已经被vTF7-3(可以持续表达T7 RNA聚合酶的痘苗病毒)感染的细胞。收获后,基因产物在细胞内的表达可以用脉冲标记的方法或用「重组痘苗病毒及其产物的鉴定实验」中叙述的方法分析鉴定。 |
|---|---|
| 实验材料 | |
| 试剂、试剂盒 | |
| 仪器、耗材 | |
| 实验步骤 | 1. 用 CsCl/溴化乙锭离心或 PEG 沉淀纯化重组质粒,每孔细胞需要 5 μg DNA 进行转染。 如果使用 pTM1 质粒(图 16.16.2), 必须保证目的基因起始 ATG 位于 pTM1 的 NcoI 位点。可以通过限制酶作图或 DNA 测序鉴定构建是否正确。 2. 在病毒感染前一天,用完全 MEM-10 培养基将 5×105 CV-1 细胞/孔加入 6 孔组织培养板培养。直至细胞几乎汇片生长(一般过夜)。用血球计数器对细胞进行计数。 3. 将 vTF7-3 储液涡旋混匀以打散团状物。按照下面的步骤用杯状超声仪进行超声: 3.1 在杯中装入冰水(大约 50% 的冰); 3.2 将装有 vTF7-3 储液的小管放在冰水上; 3.3 以最大功率超声 30 s,储液置冰水上 >30 s,再继续超声。 4. 用 Opti-MEMI 将病毒稀释至 2×107 pfu/ml。 5. 用 0.5 ml/孔的稀释病毒储液(10 pfu/细胞)感染步骤 2 制备的 CV-1 细胞。温育 30 min,每 5~10 min 晃动一次。 6. 在感染结束前 5 min 制备脂质体悬液。加入 1 ml 的 Opti-MEMI 至 12 mm× 75 mm 聚苯乙烯管中(每孔制备一管),涡旋脂质体悬液,加 15 μl 至培养基中,涡旋混匀。加入 5 μg 的重组质粒(来自步骤 1),轻轻混合均匀。 脂质体在储存期间会沉淀,因此在使用前,应将其涡旋混匀。不要使用聚丙烯管,因为 DNA/脂质体混合物会吸附在其表面。 7. 吸出 CV-1 细胞的病毒接种物,直接加入 DNA/脂质体混合物。培养 5~24 h,表达的蛋白质可以用脉冲标记的方法或用「重组痘苗病毒及其产物的鉴定实验」中叙述的方法鉴定。 |
| 注意事项 | 1. 所有培养都在加湿的 37℃ 5% CO2 培养箱中培养,除非有特殊说明。 2. 与活细胞接触的器械和试剂都应该是无菌的,操作也必须无菌。 |
| 其他 | 重组质粒:将目的基因亚克隆到 pTF7-5 或 pTM1 载体或其他含有 T7 启动子的质粒。 |
-
科技前沿
-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
并购

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件