文献解读:分层组装的DNA线框纳米结构,可用于...(一)
文献解读:分层组装的DNA线框纳米结构,可用于癌症高效成像和靶向治疗
疏水小分子化疗药物的系统分布和非靶向细胞毒性导致副作用和疗效降低,阻碍了其在癌症治疗中的广泛应用。由于包括有机聚合物、无机纳米颗粒、脂质体等药物载体的快速发展,许多靶向给药策略已经建立起来,以克服这些缺点。然而,这些合成材料的生物相容性低,降解性差和具有一定的免疫原性风险。大多数纳米药物载体,尤其是聚合物体系,总体分子量和大小难以控制,导致药物与载体的比例不均,重现性低。靶向给药的这些内在问题阻碍了其在医学和临床试验中的广泛应用。
由于DNA纳米结构的尺寸和几何形状易于预先设计和构建,它们在生物传感、生物成像、药物控制释放和智能纳米医学等领域得到了广泛的应用。为了提高与靶细胞的接触机会,三维DNA纳米结构表现出更好的可调性和结合能力。DNA折纸被认为是DNA结构纳米技术的重大突破,因为它可以轻松控制大小、形状和3D几何形状。许多DNA折纸结构已经被开发用于多重有效载荷和刺激反应药物释放。然而,内源性核酸酶降解的不稳定性和数百个未使用的短链的高成本阻碍了DNA折纸转化为临床试验。DNA多面体纳米结构具有良好的可编程性、的寻址性和明确的空间定向性,为分子医学作为药物载体在理想位置功能化药物提供了一个有前景的平台。
DNA四面体和其他多面体骨架因其易于自组装、高度耐核酸酶稳定性和良好的内化作用而被广泛报道。通过利用这些因子,各种小分子药物、反义寡核苷酸和siRNA被这些多面体纳米结构装载,以增强细胞摄取、治疗效果和生物安全性。基于有限的可编程性和载药能力不足的典型的DNA四面体(由四个ssDNA组成),谭蔚泓院士及其团队在本文中报道了一个创新的纳米结构的设计和应用:由DNA八面体线框和CA4(广谱微管抑制剂)功能化的Sgc8c寡核苷酸适配子(CA4-FS)组成。多个CA4分子可以整合在一个核酸适配体功能化的八面体DNA纳米载体中,为靶向癌症治疗提供了良好的CA4传递,可用于的癌症成像和有效的靶向治疗。


基本信息
题目:
Hierarchical Fabrication of DNA Wireframe Nanoarchitectures for Efficient Cancer Imaging and Targeted Therapy
期刊:ACS Nano
影响因子:14.588
通讯作者:谭蔚泓,柯勇刚和王雪强为共同通讯作者
作者单位:湖南大学和美国埃默里大学
索莱宝合作产品:
产品名称 | 产品货号 |
ANNEXIN V- FITC/PI 凋亡检测试剂盒 | CA1020 |
摘 要
虽然小分子药物在癌症治疗中起着至关重要的作用,但小分子药物的固有问题,如溶解性差和系统性毒性,大大降低了它们的抗癌功能,并造成了副作用。为了达到令人满意的治疗效果,必须开发创新的靶向系统,以保证抗癌药物、高效地递送。在本研究中,作者采用分层自组装策略来制备由DNA八面体线框和化学药物功能化的Sgc8c适配体组成的核-壳纳米结构。DNA纳米结构的高渗透长滞留效应和Sgc8c适配体的主动靶向能力,使得高选择性化疗药物递送和体内高效成像和治疗成为可能。作者的多功能纳米结构的优势进一步体现在其血清稳定性、优异的积累能力、深穿透能力、显著提高的治疗效果和良好的生物安全性。这项研究显示了这种核-壳DNA纳米结构在药物装载控制、药物传递和个性化用药方面的潜力。
研究内容及结果
1.DNA八面体线框的分层自组装
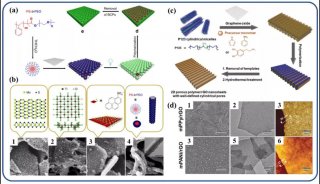
作者首先获得了单链CA4-FS,接下来通过分层自组装策略构建了一个DNA八面体。采用可编程退火的方法,构建了6个四通连接DNA块作为DNA八面体的顶点。然后DNA块通过它们的单链结构域连接在一起,形成一个DNA八面体线框。优化了构建条件后,验证了由DNA块逐步组装的DNA八面体(图1a)。AFM成像证实了八面体的形态(图1b)。为了证明药物负载的可调性,作者构建了具有不同手柄数的DNA八面体用于与CA4-FS杂交。

图1
这种DNA八面体的可寻址性和可预见性允许地装载不同数量的单链CA4-FS。作为概念验证,作者构建了半负载CA4-八面体(hCA4-Oct)和全负载CA4-Oct,并测定了负载效率(图1c)。为了进一步验证hCA4-Oct和CA4-Oct的可编程组装,作者接下来分别用Cy3标记的Oct-12H、Cy3标记的Oct-24H和Cy5标记的CA4-FS研究了CA4-Oct的荧光共振能量转移(FRET)效应。正如预期的那样,hCA4-Oct和CA4-Oct均显示出明显的FRET信号。八面体水动力尺寸为17.0±1.1nm,功能Oct-12H和Oct-24H的水动力尺寸分别为24.9±3.0和26.5±3.4nm。hCA4-Oct的大小为29.5±3.2nm,CA4-Oct的大小为30.1±3.7nm(图1d)。AFM成像也证实了hCA4-Oct和CA4-Oct的形成。这一结果表明CA4-FS指向DNA八面体核的外侧,形成三层核-壳纳米组装体。上述结果证明了在DNA八面体上可以地装载多个游离药物分子。
2.细胞内化与肿瘤球体穿透
为了最大限度地负载CA4-FS,接下来的研究选择了一个完全负载CA4修饰的DNA八面体。图2a,b结果证明了通过修饰DNA纳米结构上的适配体增强了细胞内化。竞争性阻断实验也支持了这一结论。CA4-Oct的位移大于CA4-FS。基于上述结果,作者推断,内化增强的因素有:(i)识别单元增加(24 CA4-FS vs 1 CA4-FS);(ii)八面体结构的刚度;(iii)提高CA4-Oct的稳定性。对于稳定性因子的重要作用,作者测试了CA4-Oct和CA4-FS在10%胎牛血清中的生物稳定性。8小时处理后,CA4-Oct保持不变,但55%的CA4-FS被降解。所以CA4-Oct的内化速率比CA4-FS的内化速率要快(图2b)。CA4-Oct和CA4-FS在无FBS培养基中保持了相同的完整性,表现出了相同的时间依赖性内化速率,进一步说明了至关重要的稳定因子减缓了CA4-FS的时间依赖性内化。
为了研究细胞选择性,作者还检测了PTK7阴性的NCM460细胞(正常结直肠细胞系)。与NCM460细胞相比,CA4-Oct和CA4-FS对HCT116细胞的吸收更多(图2c)。值得注意的是,与单链CA4-FS相比,CA4-Oct对HCT116细胞和NCM460细胞间CA4传递的细胞内化选择性要大得多(图2d)。可视化共聚焦成像也证实了上述发现。这些结果表明CA4-Oct比单链CA4-FS具有更多的细胞内化和选择性。为研究CA4在实体肿瘤组织中的递送深度,制备HCT116三维多细胞肿瘤球形体。与单链CA4-FS相比,CA4-Oct在肿瘤球状体中心有更高的强度(图2e)。这些发现支持了适配体壳由于其识别和结合作用而起主导作用的假说,以及DNA八面体核促进CA4-FS在肿瘤组织中的插入。
图2
-
标准

-
焦点事件

-
科技前沿

-
科技前沿

-
项目成果

-
科技前沿

-
标准

-
科技前沿
-
标准

-
焦点事件

-
焦点事件

-
科技前沿

-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿
-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿
-
技术原理
-
焦点事件

-
技术原理
-
技术原理
-
项目成果
-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件
-
技术原理

-
焦点事件

-
焦点事件

-
科技前沿
-
项目成果

-
项目成果
-
项目成果
-
科技前沿