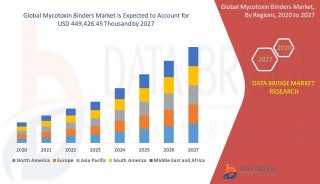
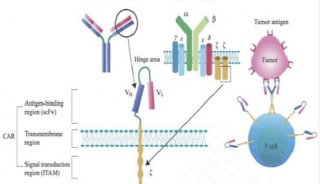
CAR-T细胞疗法针对实体瘤和血液肿瘤的全球临床试验 二
值得注意的是,注入细胞的总数取决于产品内的CAR阳性T细胞的百分比,而且在不同的研究之间和单独的试验中都是高度可变的。

CAR-T细胞产物中CAR阳性细胞的百分比(图片来源 EMBO)
对于四代CAR-T细胞,可以观察到使用直接伴随有慢病毒载体(LVs)的γ-逆转录病毒载体(RV)的轻微偏好。只有很少的临床研究使用电穿孔技术来转移CAR构建体,在大多数试验中,第二代CAR已经被转化到了临床应用上,靶向CD19的第三代或第四代的CAR正在测试。

四代CAR-T细胞疗法的临床试验数目(图片来源 EMBO)
CAR-T疗法对于癌症患者的临床效益
受益于CAR-T细胞疗法的患者最有名的病例可能就是Emily Whitehead了,作为一名患有复发性急性淋巴细胞性白血病(ALL)的儿童,现在的Emily已经健康的生存了5年了(http://emilywhitehead.com)。NCT01626495,正是Emily所参与的的临床试验。
对于B细胞恶性肿瘤,CAR-T细胞疗法似乎特别有效。究其原因是因为CD19或CD20的肿瘤细胞选择性和均一性表达,以及CAR-T细胞很容易对其进行识别。
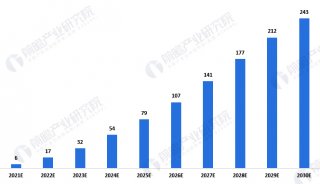
在一项CD19 CAR-T细胞疗法的临床试验中,接受治疗的243名患者(199名成人,44名儿童)中,客观应答率超过60%,而且只有20%的患者没有应答。值得注意的是,在包括儿童和成人患者在内的试验中,临床结果似乎与年龄无关(Cruz等, 2013; Maude等, 2014; Lee等, 2015; Zhang等, 2016)。

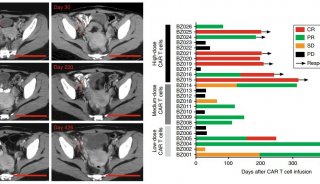
CAR-T治疗血液肿瘤的临床结果,治疗患者的数量位于靶抗原下方的括号中(图片来源 EMBO)
在编号为NCT00968760、NCT01865617、NCT01815749、NCT01626495、NCT01044069的五项临床试验中,超过85%的患者达到了最佳临床结果-完全缓解(CR)。在这些试验中,评估的时间点范围为4周(Turtle等, 2016)至30个月(Kebriaei等, 2016)。
入组患者包括在骨髓(BM)中、髓外部位或脑脊液中存在不同等级的可检测的疾病—急性淋巴细胞白血病(ALL)或非霍奇金淋巴瘤(NHL)。还包括了由BM中的母细胞百分比定义的最小残留病(MRD)或形态学疾病患者。
有趣的是,形态学疾病患者和MRD患者的缓解率似乎没有明显差异(Davila等, 2014; Maude等, 2014; Turtle等, 2016; Park等, 2017)。但是在经过18个月的随访后,MRD的患者的寿命明显更长(Park等, 2017)。因此,低水平的肿瘤负担似乎提高了CAR T细胞治疗的耐久性,至少在治疗ALL的试验中是这样的。
所以在CAR-T细胞治疗前,通过化疗降低肿瘤负担是可行的。而且在接受CAR-T细胞治疗后,获得完全缓解的患者可以接受同种异体造血干细胞移植(HSCT)的治疗,以提供额外的治疗潜力。
在针对急淋(ALL)的研究中,CAR-T细胞诱导的缓解已经通过移植进行了不同程度的巩固[n=3/30, 11%; (Maude等, 2014); n=7/14, 50% (Davila等, 2014); n=10/14, 71% (Lee等, 2015); n=13/ 27, 48% (Turtle等, 2016)]。尽管存在一些差异和短期随访的局限性,但研究之间的应答持久性似乎非常相似。这表明无论患者是否接受HSCT治疗,CAR-T细胞疗法都可能提供显著的临床疗效。
此外,在相同的研究中经常被忽视的是,大部分患者在接受CAR-T细胞治疗之前进行过移植治疗,而这表明了对移植物抗白血病效应不敏感的肿瘤对工程化CAR-T细胞而言是敏感的。
总体而言,CD19 CAR-T细胞疗法对急淋(ALL)患者最有效,在之后是非霍奇金氏淋巴瘤(NHL)以及慢性淋巴细胞白血病(CLL),这也表明了CAR-T细胞疗法在不同的癌症类型中发挥的作用是不同的。
另外,CAR-T治疗NHL的初步临床结果也是很令人激动的,在九个高级别的化疗耐药性的NHL病例中,四例患者达到完全缓解,另外两例部分缓解(Kochenderfer等, 2015)。由Kite Pharma与同一CAR T细胞产品赞助的随后试验的初步结果证实了这些结果,七个患者中有四个治疗达到完全缓解,持续12个月(Locke等,2017)。
而一般高级别的化疗耐药性NHL的预后都比较差,中位生存期仅为几周,因此这项临床结果也促使Kite Pharma向FDA提交CAR-T细胞产品(KTE-C19)的上市申请。相比较CD19,靶向血液恶性肿瘤的其他肿瘤抗原的临床疗效倒是不太明显,尽管大多数正在进行的试验还未到达终点。

CAR-T治疗实体瘤的临床结果,治疗患者的数量位于靶抗原下方的括号中(图片来源 EMBO)
与血液病恶性肿瘤得到的结果不一致的是,CAR-T治疗实体肿瘤(12种不同抗原靶点)就没有那么顺利了,但是在一项针对神经母细胞瘤患者的I期临床试验中,以GD2为靶点的CAR-T细胞疗法使患者的完全缓解率(CR)超过了50%。(Louis等,2011)。
结语

近日,Kite Pharma宣布,已向欧洲药监局(EMA)提交使用axicabtagene ciloleucel(KTE-C19)治疗顽固性弥漫性大B细胞淋巴瘤(DLBCL),转化滤泡淋巴瘤(TFL),和原发性纵隔B细胞淋巴瘤(PMBCL)的营销授权申请(MAA),用于不适用自体干细胞移植的癌症患者。此项申请是第一个向EMA提出的嵌合抗原受体T细胞(CAR-T)疗法。而诺华的CAR-T疗法CTL019(tisagenlecleucel-T)也以10:0的投票结果获得咨询委员会专家全票推荐。
美国和欧洲市场也将迎来第一批CAR-T细胞产品。然而,由于CAR的特异性设计、递送、调节和基因组编辑以插入CAR基因的无限选择,我们可以很容易想到,将来会有更多的基于CAR-T细胞的产品进入临床研究,而这也会增加治疗实体瘤的选择以及简化CAR-T细胞生产过程。

CAR-T细胞试验中的重要驱动因素(图片来源 EMBO)
研究人员则需要从迄今为止完成的试验中尽可能多地获得信息将有助于这些新举措,尽管CAR-T细胞治疗(CAR构建,制造过程,指征和临床试验设计)太过于复杂,对于不同试验结果的详细比较似乎是不可能的,但是对于所有类型的CAR-T细胞疗法常见的一些重要因素是可以临床资料中得出结论的。
最后必须强调的是,制定毒性管理计划并确定生物标志物以预测常见的毒性也是相当重要的,因为最终的总体生存数据将允许对CAR-T细胞疗法的长期效益风险结果进行真正的比较。
参考出处:
DOI 10.15252/emmm.201607485
http://www.kitepharma.com/
https://www.adn.com/nation-world/2017/07/12/first-gene-therapy-a-true-living-drug-on-the-cusp-of-fda-approval/
-
焦点事件

-
科技前沿

-
项目成果

-
项目成果

-
焦点事件
-
焦点事件

-
项目成果
-
企业风采

-
焦点事件

-
并购

-
科技前沿
-
会议会展

-
焦点事件

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿
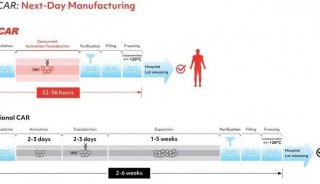
-
技术原理
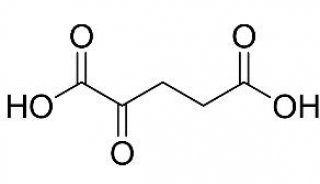
-
焦点事件
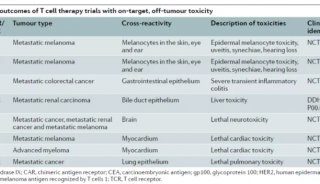
-
项目成果

-
焦点事件

-
焦点事件

-
技术原理
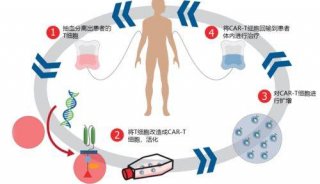
-
综述
-
焦点事件

-
项目成果

-
焦点事件
-
焦点事件

-
科技前沿
-
项目成果

-
焦点事件
-
项目成果
-
项目成果

-
焦点事件