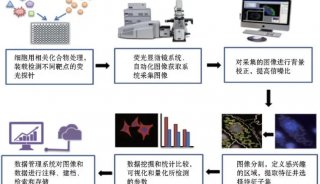
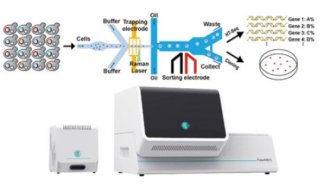
COPAS流式分选系统简介及其在药物筛选方面的应用
微型模式动物、模式植物种子、大体积细胞及微球的分选在生命科学研究中有着非常广泛的应用,但是由于这些对象体积太大,普通流式细胞仪难以对其进行分选,而手工镜下分选耗时耗力、效率低下、准确性难以保证,因此一种自动化大体积微粒分选系统应运而生,它就是本文介绍的COPASTM多参数生物微粒分析与分选系统。 COPASTM生物分选系统,这一目前市面上唯一的能够分选40-1500um生物微粒的全自动、高通量分选系统,是由位于美国马萨诸塞州的Union Biometrica公司出品。该公司作为Harvard Bioscience的子公司,专门致力于生物分选系统的研究、设计和制造。COPASTM系统可以检测微粒的尺寸、光密度及荧光信号,并根据用户设定的域值,将相应的微粒喷人96孔板或其它容器中,整个过程对于微粒的生物活性不会产生任何负面影响。
一、工作原理
COPASTM技术平台是基于流式细胞技术开发的,但它与普通流式细胞技术相比,做了两个重要的改进以适应大体积生物微粒分析与分选的需要。 第一,系统管路直径增大以适应40-1500u m大小的生物微粒,这比普通流式细胞仪用于分选单个真核细胞的管路大的多。每一个COPASTM系统都针对不同尺寸范围的微粒进行管路的优化设计,以便在高速高通量分选时获得最好的检测灵敏度与准确性。 第二,COPASTM技术的核心,即ZL的气流分选装置(图1、表1)。当不需要收集时,分选系统会通过气体将液流吹人废液槽中;当需要分选的微粒经过时,分选系统会暂时将气体分流器关闭,使气流中断,然后再重新打开分流器,这样就能将含有待选微粒的液流喷人微孔板或收集容器中。这种分选的方式非常温和,可以保证收集到的生物活体或敏感化学物质的活性和完整性,对于后续的培养和分析不会产生任何负面影响,而普通流式细胞仪一般采用电磁场进行分选,会对生物活体产生致命的影响。 COPASTM生物分选系统可以同时检测微粒的五种光学参数,包括微粒的光密度(Extinction,EXT)、微粒的轴向长度(Time Of Flight,TOF ),以及三色荧光信号(表1)。样本悬液在鞘液的包裹下形成层流,生物微粒被聚焦在液流的中心输送到流动室,通过两个低能激光器来激发和检测光信号。其中,一个红色激光器( 670nm)被用来检测微粒的轴向长度和光密度,而另一个多色氢激光器(488/514nm)被用来激发多种荧光素。仪器的标准配置包括绿光、黄光及红光检测器,用来检测受激发的荧光素发出的光信号。这些实时检测的参数被用来将样本中的微粒分群,只有那些符合用户设定域值的微粒才会被分选系统加人微孔板或样品收集容器中,而那些不在用户设定域值范围内的微粒也可以被收集起来,以备后续的其它操作。最终的分选速度取决于样本的浓度和需要分选的微粒所占的百分比,最快可以达到每小时100, 000个微粒。

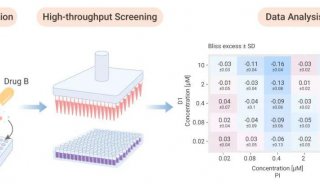
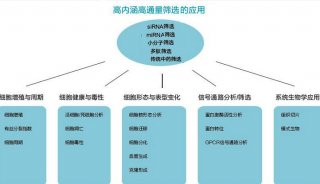
二、应用领域 COPASTM多参数生物微粒分析与分选系统被广泛应用在模式动植物研究、大体积细胞研究及药物筛选等方面,具体应用对像包括微型模式动物:C .elegans、D .melanogaster、Zebrafish、Medaka, Mosquito, Xenopus;模式植物种子与花粉:Arabidopsis、花粉;大体积细胞与细胞簇:胚胎干细胞、胰岛;微球/颗粒:化合物结合微球、微球分析。本文将重点介绍COPASTM生物分选系统在药物筛选方面的新应用。 目前的高通量化合物筛选大多使用384或1536孔板。要提高分析的速度和通量并降低样品消耗量就需要进一步增加板上孔的密度,但是对于目前的liquid handling技术而言,1536孔板已经接近其操作的极限。于是,另一种替代方法产生了,这就是基于微球的分析技术,On-bead assays(图21)。最近,一些科学家将COPASTM分选技术运用于On-bead assays中(图3),大大提高了药物筛选的效率,使筛选速度达到了每小时100000个化合物的高水平。同时,这种结合还大大节省了样品的消耗量,同样分析1000, 000个化合物,基于384孔板的方法以每孔20u1计算,大约需要20升的样品和试剂,而运用COPASTM分选技术的On-bead assays只需要20-40m1的样品。另外,COPASTM分选系统可以处理最大直径达毫米级的微粒,这样就完全可以分选500u m直径的的微球,而这样大小的微球可以满足运用MS和NMR对单个微球进行结构分析的需要。 
图2. On-bead assays技术原理(A)与COPAS微球分选示意图(B) COPASTM生物分选系统可以运用到On-bead assays技术的多个领域(图3),比如微球的质控,COPASTM可以分选出破损、塌陷和粘合的微球,从而保证用于实验的微球的完整性;根据微球表面的荧光标记进行分选;从已经结合了化合物的微球中,去除那些结合了自发荧光化合物的微球,以避免假阳性。其中根据微球表面荧光信号进行分选是用途最广的应用,现举几个例子进行说明。
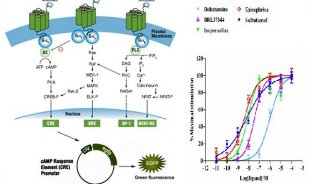
图3. COPASTM分选技术在On-bead assays中的应用(A),分选荧光微球时的散点图(B) (1)结合分析,动力学与竟争分析(BindingAssays, kinetics and competition assays) 使用COPAS生物分选系统在以微球为载体的化合物库中筛选能与带有荧光标记的目标蛋白结合的化合物,将阳性化合物微球加人微孔板以进行后续的MS,NMR及其它分析,将没有结合蛋白的阴性化合物微球加人收集容器以便重复使用。另外,还可以根据荧光信号的强弱设定域值,将阳性化合物微球进一步分为结合能力不同的几群。目前,已经有科学家利用这种技术找到了一个能与纤维原细胞生长因子粘多糖结合位点结合的硫酸盐化合物。

(2) On-bead酶一底物筛选(On-bead enzymesubstrate discovery) 将需要研究的多肤,如点突变多肤,两端标记上淬灭荧光基团(FRAP ),然后连接到微球上,从而建立一个以微球为载体的多肤库。将多肤微球与目的蛋白酶结合,如果蛋白酶能够切断多肤,就会发出荧光信号。由于使用COPAS高速分选技术,阳性微球可以被快速分选,以保证微球表面仍有足够多的完整多肤以便进行后续分析。从建立多肤库到阳性多肤序列分析的整个实验流程,可以在一周内完成,与传统方法相比效率提高了一百倍。丹麦的一个研究小组已经利用该技术研究了枯草杆菌蛋白酶的多肤底物结构。

(3)蛋白酶抑制剂筛选 COPAS技术的一个更为复杂的应用是在蛋白酶抑制剂筛选方面。首先,将带有淬灭荧光基团(FRAP )的蛋白酶底物多肤连接在微球的一部分结合位点上,然后将需要筛选的抑制剂连接在微球的其它结合位点上,从而建立一个以微球为载体的抑制剂库。将微球与蛋白酶一起孵育,如果抑制剂无效,蛋白酶会将多肤切断,微球产生较强的荧光信号。如果抑制剂效果很强,蛋白酶无法切断多肤,微球没有荧光信号。如果抑制剂无法完全抑制蛋白酶活性,那么仍会有部分多肤被切断,微球会发出较弱的荧光信号。这样就可以利用COPAS技术根据微球荧光信号的强弱对微球进行分选,从而快速找到不同抑制强度的抑制剂。这种技术在筛选抑制剂和优化反应条件方面具有很高的效率和很大的灵活性,可以实现每小时100000个化合物的高速筛选。利用这种技术,荷兰的一个研究小组在数周内找到了胰蛋白酶和多种基质金属蛋白酶的多种抑制剂。

综上所述,由于 COPASTM生物分选系统在微粒分选方面的强大功能,其与On-bead assays技术的结合必将成为药物筛选的犀利武器,从而大大提高药物筛选的效率,为人类健康作出贡献。
-
企业风采

-
科技前沿
-
产品技术
-
产品技术
-
焦点事件

-
综述
-
综述

-
综述
-
投融资

-
项目成果
-
科技前沿
-
综述
-
焦点事件

-
项目成果
-
焦点事件