CymaBay新型强效PPARδ激动剂seladelpar获FDA突破性药物资格

CymaBay Therapeutics是一家临床阶段的生物制药公司,专注于开发治疗肝脏和其他慢性病的创新疗法。近日,该公司宣布,美国食品和药物管理局(FDA)已授予seladelpar联合熊去氧胆酸(ursodeoxycholic acid,UDCA)治疗早期原发性胆汁性胆管炎(PBC)成人患者的突破性药物资格(BTD)。
seladelpar是一种口服、强效、选择性过氧化物酶体增殖激活受体δ(PPARδ)激动剂,正开发用于治疗PBC和非酒精性脂肪性肝炎(NASH)。此前,seladelpar已获美国FDA和欧盟EMA授予治疗PBC的孤儿药资格,并获得欧盟EMA授予治疗PBC的优先药物资格(PRIME)。目前,seladelpar正处于一项全球III期注册研究ENHANCE中评估治疗PBC患者的疗效和安全性。
PRIME是EMA在2016年3月推出的一个快速审批项目,与美国FDA的BTD项目相似,旨在加速医药短缺领域重点药品的审评进程,入围PRIME的实验性药物,将在临床试验及药品开发方面获得EMA的大力支持,以加速真正创新药物的开发及审批,来满足对有前景新药的医疗需求。
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病并且有初步临床证据表明该药与现有治疗药物相比能够实质性改善病情的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。
FDA授予seladelpar BTD,是基于来自一项正在进行的II期临床研究(CB8025-21629)的初步证据。结果表明,在降低碱性磷酸酶(AP)方面,seladelpar可能比现有的疗法更有效。来自该研究的初步结果已于最近在美国肝病研究协会(AASLD)和国际肝病会议(EASL)上公布。
原发性胆汁性胆管炎(PBC)是一种罕见的、严重的、可能危及生命的肝脏自身免疫性疾病,主要是因胆管(功能为将胆汁运出肝脏)遭到自身免疫性破坏,导致胆汁淤积。伴随着肝内胆管的炎症和破坏,可进展为纤维化、肝硬化和肝衰竭。PBC的其他临床症状包括疲劳和瘙痒。PBC主要是一种女性疾病,在40岁以上女性群体中的发病率约为千分之一。在美国,PBC是导致女性肝脏移植的首要病因。
-
项目成果

-
焦点事件

-
企业风采
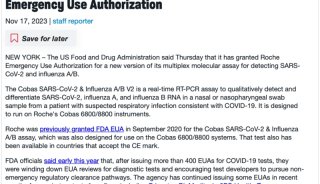
-
企业风采

-
企业风采

-
市场商机

-
政策法规

-
市场商机

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
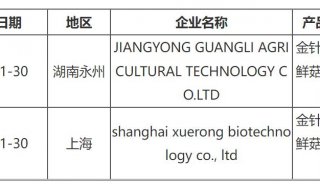
-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
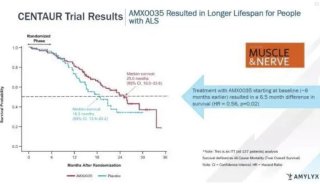
-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
科技前沿

-
焦点事件

-
科技前沿

-
科技前沿

-
企业风采

-
焦点事件

-
科技前沿

-
焦点事件

-
企业风采

-
市场商机

-
科技前沿
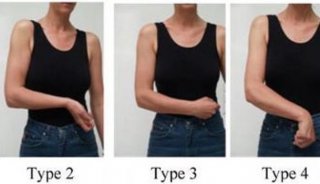
-
科技前沿

-
焦点事件

-
焦点事件

-
科技前沿

-
科技前沿
-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件
-
项目成果
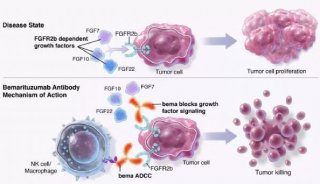
-
焦点事件

-
焦点事件

-
产品技术

-
焦点事件
-
焦点事件
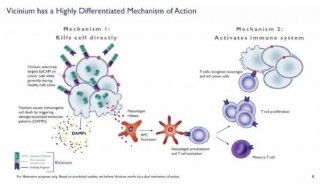
-
企业风采
-
焦点事件
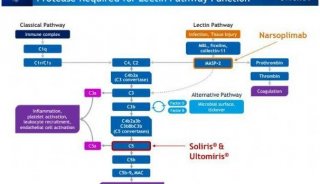
-
焦点事件

-
产品技术

-
焦点事件
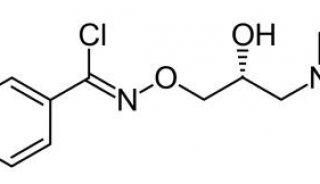
-
焦点事件

-
焦点事件
-
企业风采
-
产品技术

-
焦点事件

-
焦点事件

-
项目成果
-
项目成果
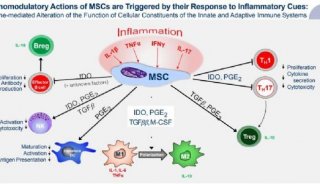
-
项目成果
-
焦点事件

-
项目成果
-
项目成果
-
焦点事件

-
产品技术
-
产品技术

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件
-
项目成果

-
焦点事件
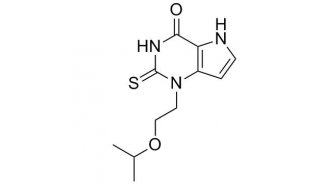
-
焦点事件

-
焦点事件
-
项目成果

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件
-
焦点事件

-
项目成果

-
焦点事件
-
焦点事件
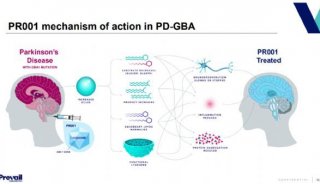
-
焦点事件

-
焦点事件
-
项目成果
-
焦点事件
-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
标准

-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件
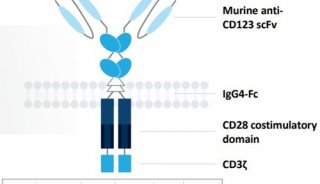
-
焦点事件
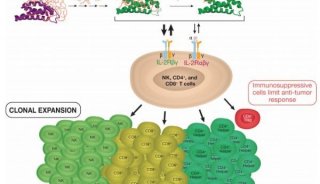
-
焦点事件
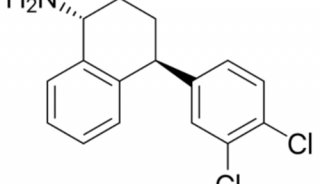
-
焦点事件
-
焦点事件
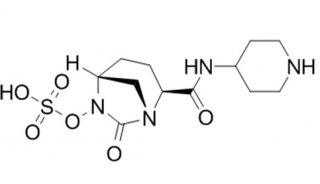
-
产品技术

-
产品技术
-
焦点事件

-
产品技术

-
产品技术
-
产品技术

-
焦点事件
-
产品技术
-
焦点事件
-
项目成果

-
焦点事件

-
产品技术

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
政策法规

-
产品技术

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
产品技术

-
科技前沿