吕志民团队等发现肿瘤细胞特异性脂质合成代谢机制
4月8日,浙江大学医学转化研究院教授吕志民团队等在《自然》在线发表研究论文,揭示了肿瘤细胞脂质感应异常及脂质合成持续激活的重要机制。

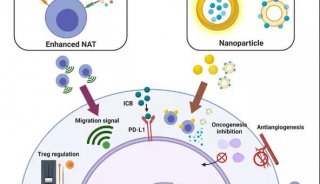
该研究不仅阐明了肿瘤细胞脂质感应异常及脂质合成持续激活的重要机制,首次发现了糖异生酶——磷酸烯醇丙酮酸羧化激酶1(PCK1)具有蛋白激酶活性,而且揭示了PCK1以三磷酸鸟苷(GTP)作为磷酸基供体对蛋白底物进行磷酸化,这有别于普遍的以三磷酸腺苷(ATP)作为磷酸基供体的蛋白激酶。同时研究也论述了PCK1的内质网易位是肿瘤细胞协同调节糖异生降低和脂质合成激活的重要分子机制。
“这项研究让人类对肿瘤代谢的认知又迈出了一步,为制造高效低毒的肿瘤药物寻找新出路。”吕志民表示,这项研究不仅为癌症的个体化治疗提供了新的代谢标记物和分子靶点,而且对靶向肿瘤脂代谢的药物研发具有重大的指导意义。
生物体内所发生的用于维持生命的一系列有序的生化反应统称为代谢,在生命体中,脂质的合成与蛋白质、核糖核酸的合成同样重要。脂质是细胞膜的组成部分,是能量的来源,也是信号传导的“信使”。
在正常的细胞中,脂质合成受到负反馈调节。当正常细胞的脂质到了一定水平,无法进入细胞核传达生产脂质的指令,脂质合成也就被抑制了。
相反,当细胞中脂质含量较低时,INSIG1/2锁住的SREBP被释放,使其从内质网转移到高尔基体,经过剪切后转移到细胞核中激活脂质合成相关基因的转录,让脂质合成工厂“恢复生产”。因此,INSIG1/2是脂质合成的重要开关,其意义在于可以避免浪费过多资源,起到自我保护、自动调控的作用。
然而这套机制在肿瘤细胞中失灵了。脂质合成就像脱缰的野马,源源不断地为肿瘤细胞的快速增殖提供物质和能量。
那么,肿瘤细胞脂质合成代谢中的负反馈调节是如何被去除的呢?
吕志民团队把目光放在了PCK1上。糖异生和糖酵解是两个相互抑制的反应,前者合成葡萄糖,后者把葡萄糖转化成能量。
肿瘤细胞需要抑制糖异生并激活糖酵解以产生充足能量。浙大研究人员发现,肿瘤细胞把原本在细胞质中发挥正常糖异生代谢酶功能的PCK1“招致麾下”,促使它完成角色转换,帮自己工作。
最终,PCK1摇身一变,以GTP作为磷酸基供体磷酸化INSIG1/2,使其与细胞内脂质的结合出现障碍,进而促进SREBP信号通路的激活及肿瘤细胞的脂质合成。
团队研究人员在动物实验和肝癌临床样本分析中揭示了PCK1-INSIG1/2-SREBP信号通路不仅促进了肝癌的发生发展,而且与肝癌患者预后和生存期密切相关。团队又进一步在肺癌、胶质瘤和黑色素瘤临床样本中做了研究,得到了同样的结果。
肿瘤的大量基因突变及特有的微环境,往往导致代谢酶原有的功能改变并赋予其新的非经典功能。
继发现糖代谢酶PKM2、PGK1和KHK-A的非代谢酶活性在肿瘤发生中的重要作用之后,该研究是吕志民团队发现的第四个具有蛋白激酶活性的代谢酶。
-
项目成果
-
焦点事件

-
科技前沿
-
项目成果
-
科技前沿

-
科技前沿
-
项目成果

-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿
-
技术原理
-
科技前沿
-
焦点事件

-
焦点事件

-
项目成果
-
项目成果

-
焦点事件

-
焦点事件

-
科技前沿
-
科技前沿
-
焦点事件

-
项目成果

-
项目成果
-
科技前沿
-
科技前沿
-
项目成果
-
科技前沿

-
科技前沿
-
科技前沿
-
项目成果
-
焦点事件
-
焦点事件