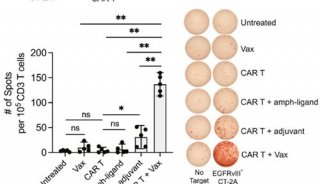
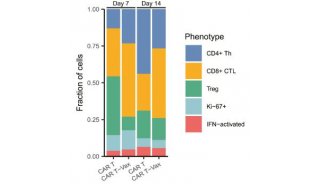
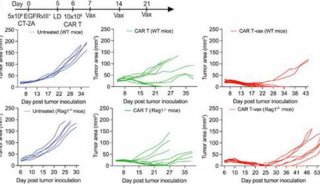
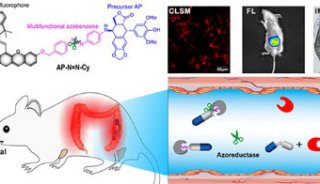
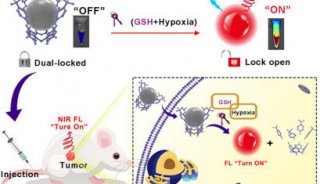
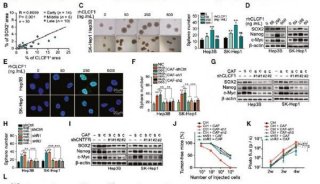
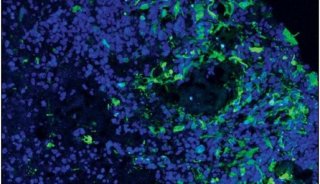
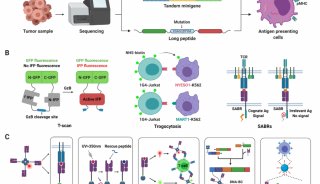
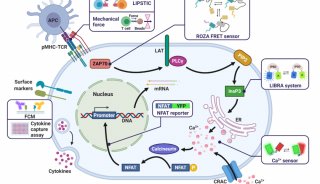
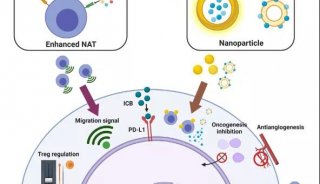
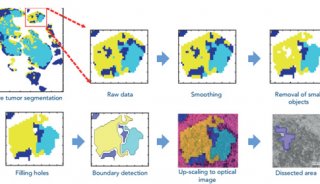
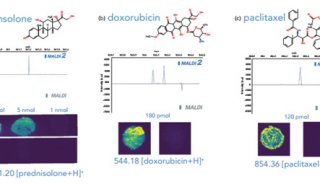
结肠直肠肿瘤细胞的培养
| 实验方法原理 | 通常用酶消化腺瘤,用手术刀片将癌组织切碎。如果分化良好的结肠直肠癌标本切开后仍不易分离细胞,可用酶消化方法分离。 |
|---|---|
| 实验材料 | 用于传代培养的Dispase |
| 试剂、试剂盒 | 生长培养液 洗液 消化液 |
| 仪器、耗材 | 培养瓶 |
| 实验步骤 |
一、酶消化 展开 |
-
项目成果
-
科技前沿

-
科技前沿
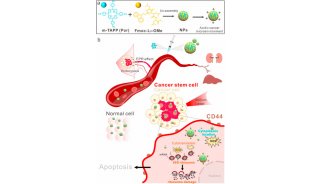
-
项目成果
-
科技前沿

-
科技前沿
-
科技前沿

-
项目成果

-
科技前沿
-
科技前沿
-
科技前沿
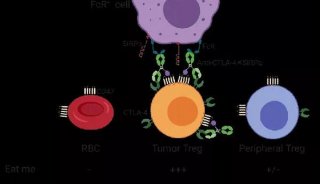
-
科技前沿
-
科技前沿

-
科技前沿
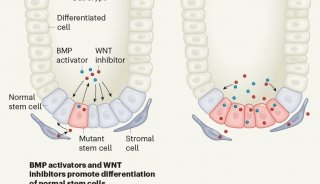
-
科技前沿

-
科技前沿

-
科技前沿
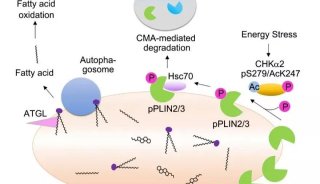
-
技术原理
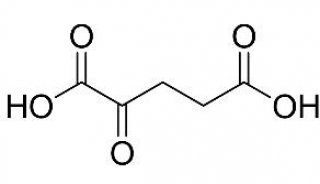
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
项目成果

-
焦点事件
-
科技前沿
-
科技前沿
-
项目成果
-
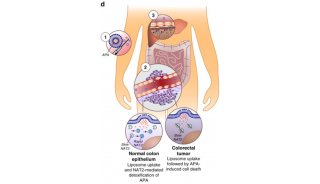
焦点事件
-
项目成果

-
科技前沿