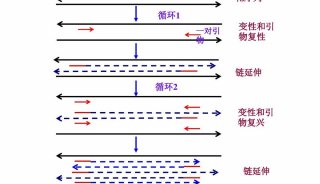
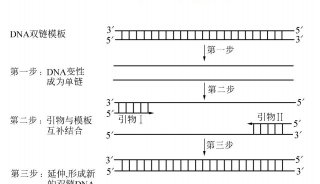
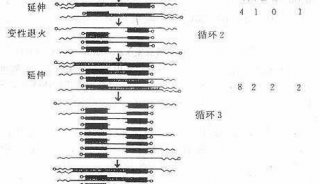
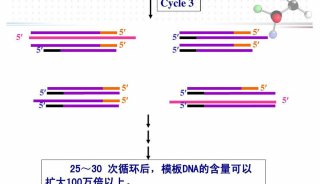
使用实时定量 PCR技术验证cDNA和差异显示PCR技术(二)
实时 RT-PCR 与 DNA 阵列结果的比较
G3PDH 是在大多数细胞中表达的含量丰富的看家基因,但在某些条件下的表达发生改变( 11 ),通过 DNA 阵列杂交发现, G3PDH 的转录本在亚克隆 20863 和 20861 中的表达相同。实时定量 RT-PCR 也发现在两个亚克隆中有着相同的转录水平 (9) ,实时 PCR 的忠实性可以由无 RT 和加水的对照以及每个基因的 CV 值得到证明。每个高强度杂交的基因平均的 CV 值为 12%( 范围: 1-25%) ,而对于低杂交强度的基因来说则为 18%( 范围: 18-28%) 。
表 1 计算相对表达水平以及变异系数
|
组 1 |
0.447 |
0.0285 |
||
|
0.559 |
0.0226 |
|||
|
平均值 |
0.503 |
0.0255 |
||
|
组内 CV |
15.7% |
16.32% |
||
|
组 2 |
0.556 |
0.0203 |
||
|
0.45 |
0.0298 |
|||
|
平均值 |
0.503 |
0.0250 |
||
|
组内 CV |
14.9% |
26.8% |
||
|
组平均值 |
0.503 |
0.025 |
||
|
组间 CV |
15.32% |
21.57% |
||
|
相对表达水平(样品 1 /样品 2 )= 0.503 / 0.525 = 20 倍 |
变异系数=标准偏差/平均值* 100
变异系数的值由 RT - PCR 的结果决定
. cDNA 和实时 PCR 得到的基因表达结果的变化在表 2 中, 实时 PCR 的结果表明了当杂交信号较高时大多数的 cDNA 差异结果 (88% , 15 / 17) 或者是在不同亚克隆间表达水平的差异可以达到 4 倍的基因得到了确定 (5 / 5) 。而在低强度杂交的样本中只有一个得到了确定 (1 / 4) 。总的来说,实时定量 PCR 确定了 81%(17 / 24) 的基因。 cDNA 阵列和实时 PCR 得到基因表达量上的差异也有差别。例如,在 14 个由实时 PCR 验证的基因中,有 10 个表达的差异水平要超过由 cDNA 阵列确定的表达水平。
验证 DD-PCR结果
DD-PCR 条带的选择和基因特异性引物
DNA 阵列和 DD-PCR 技术间主要的差别在于 DD-PCR 条带上并没有序列信息。因此,验证的第一步就是要从 DD-PCR 结果胶中切下目的条带并从中回收 DNA 。切下选择的条带按照荧光 DD-PCR 手册 (Beckman and Coulter, Inc., Foster City,CA) 进行, PCR 得到的反应结果按照 DD-PCR 的条件进行重新扩增,经凝胶回收后再进行测序。将测序结果中未知序列小于 10% 的条带用于验证反应。包含有混合序列的条带不适用于用于验证反应,除非能确定主要序列。确定好序列后,就需要设计引物来进行上述的反应。
实时 PCR 和 DD-PCR 结果的比较 s
在本例中,使用优化的荧光 DD-PCR 系统 (Beckman Coulter, Inc.) 来验证未分化的单层细胞与亚克隆 20861 基因表达的差异。按照荧光强度的不同,将条带相对的表达水平分为 2-4 倍, 5-10 倍和大于 10 倍。根据绝对的荧光值将条带分为弱、中等和强三类。(表 3 )。
条带 I 设计的引物得到的 . 扩增结果在所有的 cDNA 稀释度中均有重叠。这表明了条带 I 在单层细胞与亚克隆中有着相同的表达, DD - PCR 和实时 PCR 得到的结果有一致的。不同稀释度得到的融解曲线(结果未显示)表明设计的引物均得到了特异性的结果,实时 PCR 用来验证了全部的 13 条差异片段。弱及中等强度信号条带的 CV 值为 10.4% ( 3 - 28.5 )。而对于强信号的条带来说则为 18% (范围: 0.8% )。实时 PCR 验证了除了一个外,全部的( 1 / 13,92% )的 DD - PCR 结果代表了一个已知基因或 EST 。而且不同信号强度的代表了不同相对表达水平。
技术细节 :
RNA 质量是所有基因表达分析中最重要的变数。商业化的 RNA 提取试剂盒可以得到极好的纯度和无降解的 RNA ,这可以适用于酶的反应以及基因表达分析的检测系统。 RNA 的完整性应当在长时间的保存过程中得到保证,因为基因表达谱分析有时候只能在 RNA 提取的数周或数月后才能进行。总 RNA 应该用 DNase I (0.4 u/ m g RNA) 按照试剂盒的要求进行处理。 RNA 用 UV 分光光度计进行定量,并用甲醛的琼脂糖电流来检测降解程度( 12 )。
2 .如果 RNA 的量有限 (10 m g) ,有另一种方法可以替代 DNase I 处理( 13 )。方法是在 RT 反应中加入逆转录酶之前先用 DNase I 来处理 RNA ,以避免由酚——氯仿抽提时造成的 RNA 的损失。我们在实时 RT - PCR 实验中验证了用 DNase I 处理有限 RNA 样品的效果,非常令人满意。
3. 如果实验样品 RNA 有限,可以用较易获得的同一种/基因型(人的来自 cDNA 的 RNA 或是来自鼠 cDNA 的鼠 RNA )的 RNA 用于确定最优化的退火和信号读取温度。但是,从这些资源得到的 RNA 应该按照样品处理的方法进行同样的处理,因为 Tm 值会受到残留盐和其它方法的影响。
4. 有些引物对也许会在不同的引物退火温度和加热时间的情况下产生几个峰的融解曲线。这也许表明引物存在非特异性或者是表达存在不同的剪接转录本或者发现有新的基因家族成员。在这种情况下可以把反应样品从反应管中取出进行凝胶电泳并进行产物测序。
结论 :
采用热启动 PCR 和在特异产物 Tm 值以上进行荧光信号读取可以使基于 SYBR Green I 染料的实时 PCR 变得敏感而特异( 10 )。这里描述的技术可以使 cDNA 阵列中高和低强度杂交信号和 DD - PCR 中低到高强度信号的每个基因的 CV 值为 15% 。平均 CV 值低于通常报道的 25 - 25% 。大部分通过 cDNA 阵列和 DD - PCR 方法得到的差异基因可以通过实时 PCR 技术得到确证(采用 1 : 200 到 1 : 20000 的 cDNA 稀释, 20ul 反应体系中加入 1ul 的模板 RNA )。因为实时 PCR 方法可以采用极低量的 cDNA ,验证由高通量方法得到的 100 - 1000 个基因只需要 1 m g 的总 RNA 。如采用 Northern 杂交或 RNase 保护方法进行验证,则至少需要 5 m g 的总 RNA ,这接近于采用实时 PCR 反应分析的 5000 倍。
实时 PCR 技术验证的不同表达强度信号的 DD - PCR 条带表明了对 DD - PCR 条带的验证并不依赖于条带的信号强弱。另一方面,杂交信号的强弱和基因的相对表达水平对 cDNA 阵列结果的影响也得到了验证。与采用的筛选技术相比,实时 PCR 得到的结果在基因表达水平上有很大的不同。这种不同也许是由于采用筛选技术和 DD - PCR 技术时没有办法采用特异性的引物来区分同一个基因家族。除非 DNA 阵列技术采用了针对序列特异转录本的优化,否则 cDNA 阵列杂交结果就有可能被交叉杂交或重复制的基因家族成员所遮盖。简单的,为 DD - PCR 条带设计特异性的引物也受到序列信息不足和新的转录本的限制。实时 PCR 方法作为一种辅助的验证方法,有可能成为只使用少量 RNA 的情况下,定量大量已知和新基因表达变化的快速的新途径。
参考文献
Der, S. D., Zhou, A., Williams, B. R. G., and Silverman, R. H.(1998) Proc. Natl. Acad. Sci. USA 95, 15623–15628.
Eisen, M., and Brown, P. O. (1999) Methods Enzymol. 303, 179–205.
Winzeler, E. A., Schena, M., and Davis, R. W. (1999) MethodsEnzymol. 306, 3–19.
Schuchhardt, J., Beule, D., Malik, A., Wolski, E., Lehrach, H.,and Herzel, H. (2000)Nucleic Acids Res. 28 (10), E47.
Poirier, G. M. C., and Erlander, M. G. (1998) Methods 16, 444–452.
Siebert, P. D. (1997) in Methods in Molecular Medicine, Vol 13:Molecular Diagnosis of Infectious Diseases (Reischi, U., Ed). Huduresmana Press, Clifton, NJ.
Higuchi, R., Fockler, C., Dollinger, G., andWatson, R. (1993) Bio / Technology 11,1026–1030.
Wittwer, C. T., Herrmann, M. G., Moss, A. A., and Rasmussen,R. P. (1997)BioTechniques 22, 130–138.
Rajeevan, M. S., Vernon, S. D., Taysavang, N., and Unger, E. R.(2001) J. Mol. Diagn.3 (1), 26–31.
Morrison, T. B., Weis, J. J., and Wittwer, C. T. (1998) BioTech sity, niques 24,954–962.
Schmittgen, T. D., and Zakrajsek, B. A. (2000) J. Biochem. Bio-phys. Methods 46 (12), 69–81.
Sambrook, J., Fritsch, E. F., and Maniatis, T. (1989) in MolecularCloning: A Laboratory Manual, Cold Spring Harbor LaboratoryPress, Cold Spring Harbor, NY.
Huang, Z., Fasco, M. J., and Kaminsky, L. S. (1996) BioTechniques 20, 1012–1020
-
焦点事件

-
科技前沿

-
综述
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件