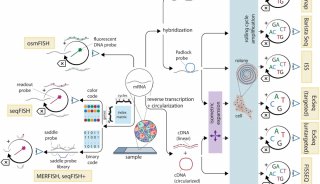
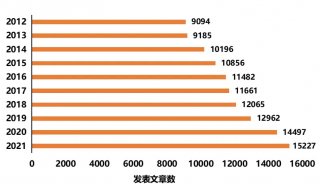
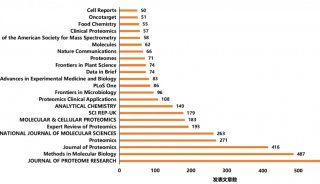
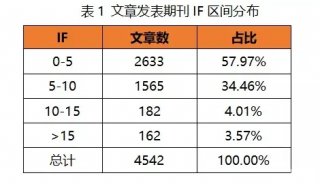
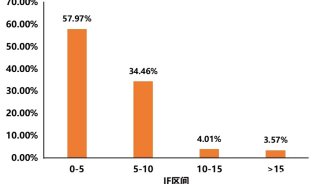
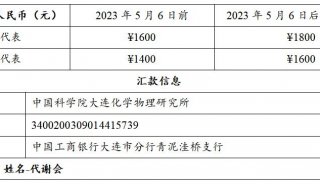
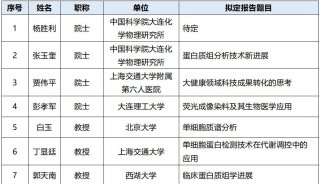
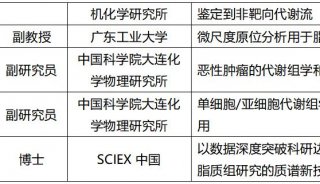
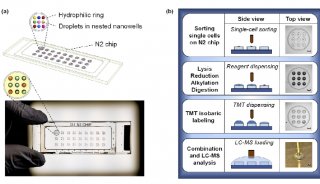
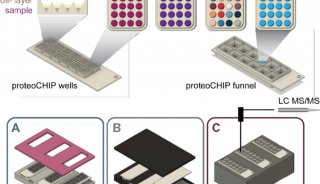
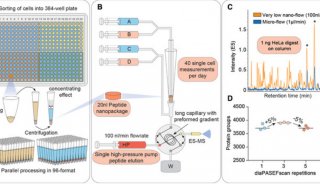
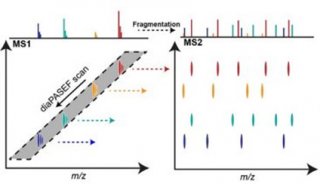
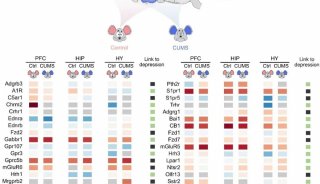
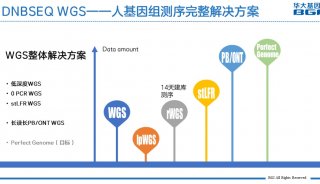
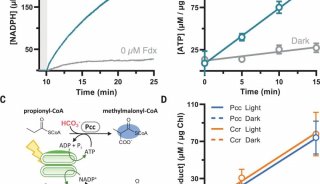
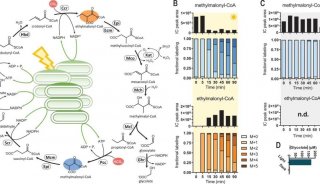
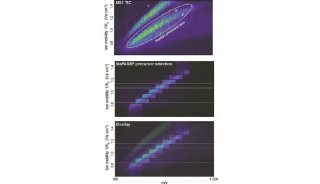
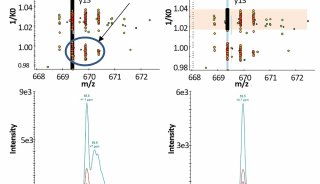
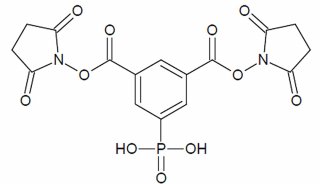
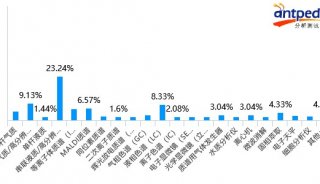
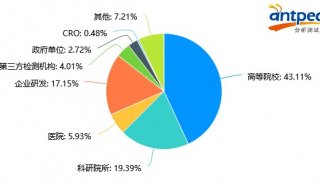
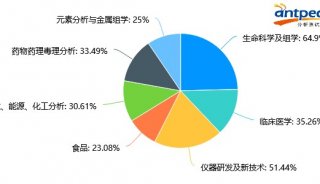
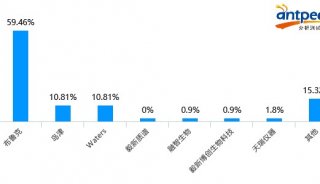
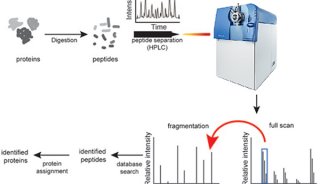
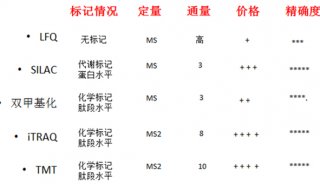
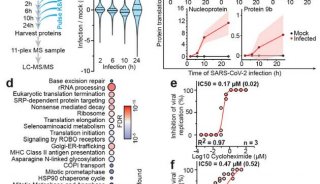
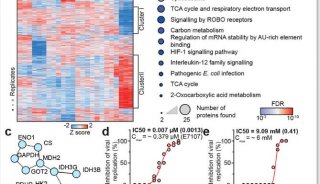
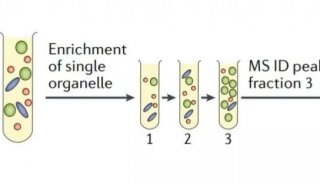
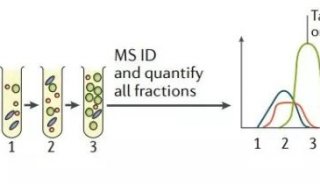
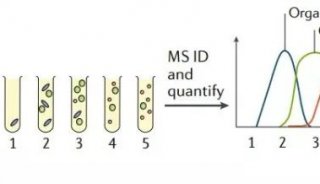
最新精准医疗蛋白质组里程碑事件的思考与研究成果 二

在上述的研究数据与结论、以及其重要的临床意义下,该研究的背后也许还存在着更多的意义和价值:
1. 肿瘤是基因病吗?
这是一个学术结论相对明确,但是在某种程度上也许又不完全明确的定义。以2001年人类基因组草图的绘制完成为起点。多年以来,在肿瘤的相关领域内,无论是科学研究、临床诊断、临床治疗领域,亦或是如火如荼的生物产业领域,基因、转录水平的检测是最火爆、最必不可少的切入点和工具。相比于全民知晓的人类基因组计划,即使是学术圈的科研人员,知道2014年人类蛋白质组草图绘制完成的也是寥寥无几。然而,随着人类蛋白质组草图的绘制完成,基因检测一家独大的局面发生了变化。从2014年到2018年陆续在《Nature》《Cell》正刊及其子刊发表了多篇重磅成果,已经完成的精准分型组学研究包括:子宫内膜癌、结直肠癌、乳腺癌、卵巢癌和胃癌等。

上述研究模式是将基因组、转录组、蛋白组及翻译后修饰组的大数据整合起来,从多分子层面的大数据重新定义疾病的分型、挖掘潜在的治疗靶点,最终在蛋白水平上发现与验证肿瘤相关基因突变、表达变化及关键分子调控机制,以进行更精准的用药指导和药物开发,即所谓的“Proteogenomics”。幸运的是,该模式不仅停留在研究阶段:在2016年美国癌症登月计划(Cancer Moonshot 2020)落地的同年,美国VA、DoD、NCI三部门联合宣布将建立第一个同时进行基因信息和蛋白信息表征的医学系统,把基因组和蛋白质组作为常规检测手段,对癌症病人进行个性化蛋白基因组(Proteogenomics)表征,为更精准的用药提供指导,即“阿波罗计划”(APOLLO)。“阿波罗计划”正式将Proteogenomics作为核心理念和工作方式。

然而,虽然蛋白质组被越来越多地重视,但实际情况是:蛋白质组的研究仍然需要“背靠”基因组、转录组。蛋白质组学的数据一定要跟基因、转录进行比对,且更多关注于两者数据的一致性,即蛋白质组进行精准医疗的研究一直以“Proteogenomics”的形象出现,而不是 “Proteomics”独当一面。2018年,同样来自上述研究团队的秦钧教授,在Nature子刊《Nature Communications》上发表的《A proteomic landscape of diffuse-type gastric cancer》的研究,发起了“Proteomics”独自走上前台的第一枪,该研究不仅为弥散性胃癌的精准分型提供了依据,其中发现的蛋白水平与基因水平数据的表达“异常”情况,也非常有启发意义。

本研究中,虽然也分析了基因、转录水平的数据,但从文章名称就可以直接看出,不再是《Proteogenomics…..》而是《Proteomics……》,是蛋白质组真正独抗大旗。我想这不仅对众多蛋白质组学人具有重要的意义,而且对于肿瘤的研究、精准诊断、精准治疗的未来发展方向也将具有重要的意义和启示。从最根本的生物层面不难理解:DNA、RNA并不是功能分子,而蛋白质才是,蛋白质是绝大多数的肿瘤药物的治疗靶点,以及最重要的临床诊断指标。目前无数的研究数据告诉我们,无论是肿瘤领域还是其他医学领域,抑或是植物学领域等等,转录组与蛋白质组数据的整体相关性是不高的。虽然从技术角度来说,与测序等技术相比,蛋白质组水平的分析技术还存在很多瓶颈,但从最终的生物意义和临床意义为出发点,蛋白质分子必然应该成为主导。
2. 还是那句话,肿瘤是基因病吗?
我们再从另外一个角度来探讨该问题。该研究的重要性,除了指导早期肝癌的精准分型,还在于其发现了一个促癌机制和潜在治疗靶点——胆固醇代谢失稳与SOAT1。这就延申到了另外一个重要的分子层面——肿瘤代谢。肿瘤是一种代谢疾病,我想这个定义很多研究者都不会反对。肿瘤代谢是肿瘤领域最热点、最有活力的方向。而近年来,国外的研究者已经意识到,代谢层面也可能帮助我们指导肿瘤的精准分型。这两年,已经看到不少顶级杂志的高水平研究揭示了代谢分子与肿瘤分型与预后的关系。例如,《Cell Metabolism》上的一项研究通过蛋白质组学、代谢组学等实验,揭示了HGSOC的代谢异质性,也阐明了慢性氧化应激与早幼粒细胞白血病蛋白过氧化物酶体增殖激活受体共激活子1α (PML-PGC-1α)轴之间的联系(对卵巢的化学敏感性有显著影响)。(Cell Metabolism:揭开“沉默的杀手”面纱,代谢组学+蛋白质组学进行高级别浆液性卵巢癌分型)以及,《Cancer Cell》的一篇研究曾经对138例肾透明细胞癌(ccRCC)患者的癌组织与正常组织进行了代谢组学分析,并通过与TGCA数据库中的转录组数据以及临床信息进行联合分析,对ccRCC在代谢层面上进行了分子分型。(Cancer Cell:代谢组学如何玩转大队列临床样品)
然而,虽然代谢与肿瘤的关系已经研究得如火如荼了,但是大部分研究更多关注的是极性代谢物(如氨基酸、糖代谢、核苷酸等),而这篇文献发现的新的促癌机制及靶点则是脂质代谢。事实上,脂质可以说几乎参与所有生理过程与疾病。因为,脂质是生物膜的重要组成部分,而生物膜构成了细胞的各个亚细胞;同时,生物膜上还存在着大量的功能分子,例如该研究发现:SOAT1蛋白表达与细胞的胆固醇的摄入密切相关,进而通过影响分子整合素家族的丰度,参与肿瘤细胞的增殖和迁移。所以,脂质的变化可通过影响亚细胞、以及细胞膜上受体等大分子的功能,参与绝大部分的生理和病理过程。另外,脂质还是重要的能量物质。而脂质与肿瘤发生发展与治疗的关系,目前的研究还非常少。换句话说,也许我们可以从脂质组作为起点,通过描绘脂质的异常变化,从另外一个路线找到调控脂质的关键蛋白SOAT1。
总结:
该研究不仅让我们看到了早期肝癌的诊断、治疗的新希望,也看到了蛋白质组技术应用于精准医疗的重要价值和应用潜力,同时我们还看到肿瘤代谢(尤其是脂质代谢)的重要性及其研究前景。该研究必将成为蛋白质组与精准医疗发展历史进程中一个重要的里程碑!向走在精准医疗前沿的我国研究者致敬!!
-
焦点事件

-
焦点事件

-
政策法规
-
精英视角

-
精英视角

-
企业风采

-
会议会展

-
精英视角

-
企业风采

-
企业风采

-
焦点事件

-
焦点事件

-
会议会展

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
会议会展

-
焦点事件

-
产品技术

-
投融资

-
焦点事件

-
项目成果
-
科技前沿

-
焦点事件

-
产品技术

-
科技前沿

-
项目成果
-
焦点事件

-
产品技术

-
焦点事件

-
企业风采

-
产品技术

-
科技前沿
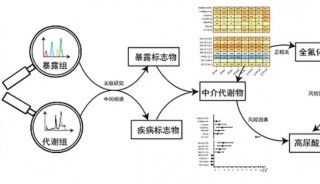
-
焦点事件

-
精英视角

-
焦点事件

-
综述
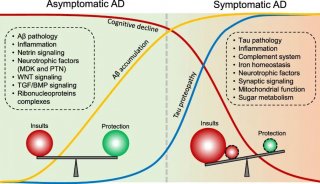
-
会议会展

-
项目成果
-
企业风采

-
焦点事件

-
产品技术

-
科技前沿

-
技术原理
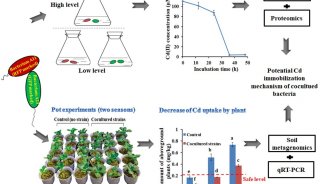
-
产品技术

-
会议会展

-
焦点事件

-
企业风采
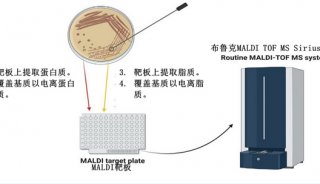
-
综述
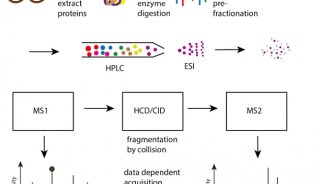
-
焦点事件

-
焦点事件
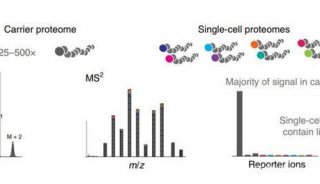
-
科技前沿

-
焦点事件

-
会议会展

-
项目成果

-
会议会展

-
会议会展

-
企业风采

-
企业风采
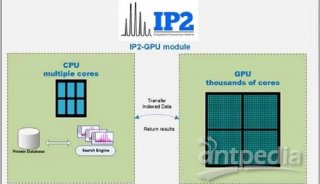
-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
科技前沿

-
焦点事件

-
焦点事件

-
技术原理

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
项目成果

-
项目成果

-
科技前沿

-
精英视角

-
焦点事件
-
产品技术
-
会议会展

-
精英视角

-
焦点事件
-
焦点事件

-
焦点事件