藻蓝蛋白的提取、纯化及紫外可见光谱仪检测藻蓝蛋白...-1
一、实验目的
学习并掌握提取、纯化藻蓝蛋白及紫外可见光谱仪检测蛋白纯度的方法
二、实验材料
螺旋藻藻粉
三、实验设备
天平,量筒,塑料杯,药匙,小烧杯(5个),铁架台,铁夹,玻棒(若干),胶头滴管(若干),滤纸,收集器,树脂柱,梯度洗脱器,蠕动,磁力搅拌器,高速离心机
四、实验原理
1.冻融法:将细胞置低温下冰冻一定时间,然后取出置室温下(或40℃左右)迅速融化。如此重复冻融多次,细胞可在形成冰粒和增高剩余胞液盐浓度的同时,发生溶胀破碎。
2.盐析法:蛋白质在稀盐溶液中,溶解度会随盐浓度的增高而上升(盐溶),但当盐浓度增高到一定数值时,其溶解度又逐渐下降,直至蛋白质析出(盐析)。盐析的发生在于盐浓度增高到一定数值时,使水活度降低,进而导致蛋白质分子表面电荷逐渐被中和,水化膜逐渐被破坏,最终引起蛋白质分子间相互聚集,并从溶液中析出。
3.DEAE-纤维素:英文名称 DEAE-Cellulose,二乙基胺乙基纤维素,总交换量0.9meq/g功能基:二乙基胺乙基.弱碱性阴离子交换剂。
原理:含有某些功能基团,可以进行离子交换。性能比一般离子交换树脂温和,适用于分离具有生物活性的大分子,可以将性质相近的大分子物质分开。
4.葡萄聚糖凝胶:商品名称Sephadex,是效果较好的分子筛凝胶层析。
原理:分子筛指多孔介质。小分子能进入介质内部空隙,大分子物质排阻在介质之外,从而达到分离目的,这种作用为“分子筛效应”。
5.装柱:装柱前先将层析柱垂直固定在支架上。装柱的方法分干装和湿装两种。干装法是直接加吸附剂到柱中,然后倒入溶剂,此法不易将气泡排尽。湿装法是先加适量溶剂到柱中,排走其中的空气,然后把预先用溶剂浸泡好的吸附剂搅匀,随机将此悬浮液连续倾入柱中,打开柱下端出口,让溶液慢慢流出,使柱上端悬浮液缓缓下降至需要的高度,吸附剂表面要平整,应使其一直浸没在溶剂中,以防气泡产生。
6.加样:经过平衡的层析柱当平衡液流到与固定相表面一致位置时,用滴管轻轻地把分离样品的溶液加到固定相表面,要尽量避免冲动基质。加入样品液的体积一般应小于床体积的1/2(体积越小越有利于提高分辨率)。
7.洗脱:待样品液的液面流到固体相表面时,用滴管加入洗脱剂(5cm),并在柱上端与装有洗脱剂的储液瓶连接开始洗脱。同时在柱下端与部分收集器接通,立即进行分级收集(按体积或时间分管收集)。
洗脱流速:如果太快,洗脱物在两相中的平衡过程不完全,如果太慢,洗脱物会扩散。
8.测定:随后将收集的每管溶液进行浓度或活性测定。根据测定结果,即可绘制出洗脱曲线(以管号或洗脱体积为横坐标,以每管溶液样品的浓度或活性为纵坐标)。
五、实验步骤
1.取螺旋藻粉颗粒20粒,每颗0.5g,一共取藻粉0.5g/粒×20=10g,倒入塑料瓶中,加提取液100ml。
2.将塑料瓶用滤纸封住瓶口置低温(-20℃)下冰冻一定时间,然后取出置室温下(或40℃左右)迅速融化。如此反复冻融多次(实验中此步骤我们只做了一次,其余由老师帮做),细胞可在形成冰粒和增高剩余胞盐浓度的同时,发生溶胀破碎。
实验现象:解冻前:墨绿色固状(略带紫色)解冻后:墨绿色溶液
3.冻融所得溶液分两次在10000rpm下高速离心15min,得到亮蓝色上清液 67.8ml,用小烧杯收集,弃去下层墨绿色沉淀。
4.称取之前已经研磨好的(NH4)2SO4固体粉末8.72g,分多次缓慢加入小烧杯中,边加边搅拌,使溶液的(NH4)2SO4浓度达到20%。在10000rpm下高速离心15min,离心沉降后,取得亮蓝色上清液67.2ml,弃去蓝色沉淀。
5.称取之前已经研磨好的
(NH4)2SO4固体粉末12.7g,分多次缓慢加入小烧杯中,边加边搅拌,使溶液的(NH4)2SO4浓度达到50%。在10000rpm下高速离心15min,离心沉降后,取得深蓝色沉淀,弃去黄绿色上清液。加不超过15ml蒸馏水溶解所得沉淀备用(水因尽量少,有利于渗析)。
6.剪取约25cm长的层析袋,放入烧杯中煮沸5min(从水沸开始计时),将其中一头用细线扎住,对折后再用细线扎住。将之前溶解沉淀的溶液倒入层析袋中。放入蒸馏水中,4℃ 下透析2—3天。
7.取一支层析柱,检漏后清洗干净,用两个铁夹固定在铁架台上,要从正面和侧面检查是否竖直,如不竖直则作出调整。称取
40gDEAE—纤维素—52于一烧杯,加150ml0.5MHCL溶液,轻搅,浸20min,小心倒掉上清液,补水到同一刻度,轻轻搅拌溶液,均匀地倒入柱中。柱中液面上要保留2~3cm的空间,之后液面每下移到原刻度位置,就补水到相应高度,使蒸馏水始终高于填料2cm以上。
8.以下由老师完成。用0.5MNaCL__0.5MNaOH溶液融胀20min,再用蒸馏水洗至中性。接着用0.5MHCL溶液融胀20min,再用蒸馏水洗至中性。后用0.5MNaCL__0.5MNaOH溶液融胀20min,再用蒸馏水洗至中性。最后用0.02M,pH6.5磷酸缓冲液平衡过夜。至此,层析柱准备完毕。
9.剪一片刚好可以覆盖填料平面的滤纸,轻放入填料面。将准备好的层析柱中的缓冲液放出,待液面比填料高出大约只有1cm
时,关闭柱开关。用胶头滴管吸取透析后的藻蓝蛋白粗提液,伸入柱液面内,沿管壁以很慢的速度将粗提液滴到液面中部,待液面升高后可以加快滴加速度。待液面离柱口只有大约2cm距离时,把开关完全打开,一边继续滴加粗提液。
现象:开始有颜色分层,由上到下分别为蓝色,绿色,黄色
10.待粗提液液面比填料高出大约只有1cm时,滴加50ml,0.02M,pH6.5磷酸缓冲液冲洗残余粗提液,不要一次加入,应先加少量把残余粗提液冲洗干净
(至溶液澄清为止),再大量加入。最后加入0.5MNaCL—0.02M,Ph6.5磷酸缓冲液(流速:1.0ml/min)。
第一次洗脱后现象:洗脱一段时间后出现红色层,最后出现明显的四个分层,由上到下分别为蓝色,绿色,青色,粉红色。
11.小心观测,待有浅蓝色溶液流出时,马上开始收集,5ml一管(共收集了14管)。由于气温较高,边收集边将收集好的溶液倒入试管,用滤纸封口,排好顺序,贴上标签4℃保存待测。
收集到试管后,试管内溶液的颜色变化:浅→深→浅
12.取出冷冻保存的试管,以磷酸缓冲溶液为空白对照管,用分光光度计测其OD620nm,。实验结果见表1。
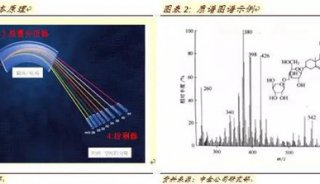
13.根据A620nm可知,蛋白含量最高为第4管,取该管溶液稀释后用紫外可见光谱仪作200nm~700nm扫描,测藻蓝蛋白纯度。实验结果见表2及附件。
六、 实验结果
1. 表1:过柱后收集的提取液OD620nm
|
管号 |
A620nm |
|
1 |
1.290 |
|
2 |
2.345 |
|
3 |
2.590 |
|
4 |
2.600 |
|
5 |
2.592 |
|
6 |
2.592 |
|
7 |
2.591 |
|
8 |
2.011 |
|
9 |
0.516 |
|
10 |
0.337 |
|
11 |
0.223 |
|
12 |
0.192 |
| 13 | 0.187 |
| 14 | 0.166 |
2. 表2紫外可见光谱仪测藻蓝蛋白纯度
| 管号 | A280 | A620 | A620/A280 |
| 4 | 1.206 | 0.614 | 0.509 |
-
科技前沿
-
焦点事件