DNA酶I足迹分析法实验2
| 实验材料 | |
|---|---|
| 试剂、试剂盒 | 适当的限制性内切核酸酶100%乙醇及冰冷的70%乙醇TE缓冲液[α-32P] dNTP (3000〜6000 Ci mmol)水溶液1O× Klenow片段缓冲液E. coli DNA聚合酶1的Klenow片段5 mmol L 4dNTP 混合液脱氧核糖核酸酶I (DNA酶I; EC3.L4.5)分析缓冲液A或B干冰DNA酶I终止缓冲液DNA酶I储存缓冲液甲酰胺加样缓冲液 |
| 仪器、耗材 | 10 mL 一次性塑料管硅烷化1.5 mL微量离心管可调节水浴锅(±0. 1℃)12 in×7.5 in大小的玻璃或不锈钢碟有盖子的塑料微量离心管6 mm宽间隔12 mm的DNA测序胶梳平头Hamilton注射器(29-G 用于0.4 mm胶) |
| 实验步骤 | 1) 用胶片扫描装置构建一个该胶片的二维数字图像。 2) 对每个结合位点的被保护DNA区带,在每条泳道 上(也就是各配体的每一浓度)的光密度进行积分。 最好是将连续的条带群作为单独一组(即图中的方块)来分析。只要所有被包括在内的条带均匀地出现,这种简化是合适的。在所有的泳道上密度最大而且密度较相似的条带之间的最低密度处(也就是高度保护区)画出边界以选定各方块的两端。很关键的是,胶片的每泳道中各方块内都含有完全相同的条带。 3) 为胶片局部背景光吸收而校正各泳道中的各方块的光密度积分值。可用图像分析软件进行如下计算: a. 在各方块所在位置上,选定各泳道之间空白处的中心,定义小长方形 b. 计算各小长方形中的像素光密度值的直方图,将概率最高的像素光密度值定义为局部背景。 c. 对于每方块和每泳道,分别算出泳道每侧的平均背景值。 d. 将该平均值乘以方块中的像素数目。 e. 从光密度积分值中减去所得值即得到该方块中的光密度积分校正值。 4) 将各组结合位点的校正光密度积分值对该泳道中的总DNA值进行标准化。 a. 选择1个或多个方块,除去滴定点及非常高敏感的区带,来代表泳道中的DNA总浓度。 b. 按步骤2及步骤3测定这些标准块的光密度积分校正值。 c. 计算每组结合位点的光密度比值(Dsite/Dstd)。如果选择不止一个标准组(方块),则将其和作为Dstd。 选择两个大标准块较为实际,也足够了。其中一个靠近电泳起始处而远离结合位点, 另一个则在离起点更远处。仔细检查每个标准块内配体浓度依赖性的系统误差,这种误差可导致标准无效。 5)将OD比值按以下公式换算成保护分数值(f): f= 1-( Dn, site/Dn,std)/ ( Dr, Site / Dr, std ) 式中,n为确定蛋向质配体浓度的任一电泳道;r为参考泳道(每个实验都必须设置), 其中在反应混合物中不加蛋白质配体。用各组结合位点的/值对蛋白质配体浓度制作结合曲线。 如果按所述的方案做,而对照实验(Brenowitz et al.,1986a,b)显示DNA酶I的作用对蛋白质-DNA结合平衡常数无影响,f值就达到了饱和分数值(F)。能观测到的f值往往不能覆盖全程(0〜1)。其原因之一是无法在加DNA酶I之前计算DNA的切口 (也就是,即便在饱和配体浓度时,Dn,siK>0。因此,在分析数据时,最好将f值定义为与结合曲线成正比的转换曲线,将两条曲线的极限值U和f分别为上限值和下限值)作为可调节参数。 对于单结合位点或相互之间无协同作用的多结合位点,其结合曲线为Langmuir等温线. 展开 |
-
焦点事件

-
焦点事件

-
企业风采

-
科技前沿
-
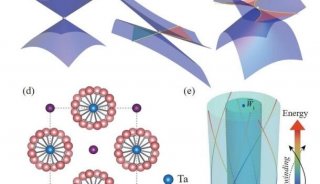
项目成果
-
焦点事件

-
实验室动态

-
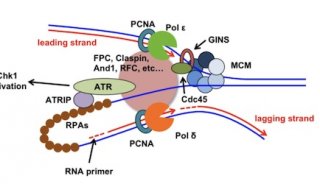
技术原理