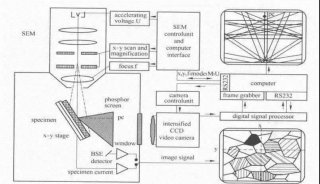
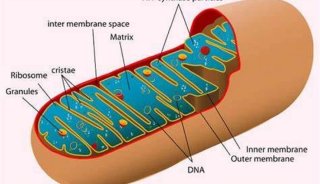
细胞线粒体内部精细结构研究(一)
生物圈的小伙伴肯定还记得前段时间的一则刷屏新闻:
北京大学陈良怡教授团队和华中科技大学谭山教授团队合作,成功发明了一种新型结构光照明超分辨显微成像技术——海森结构光照明显微镜。研究成果于高水平学术期刊Nature Biotechnology(IF=41.67)进行了发表。
之所以轰动,是因为该技术拥有超高的采集速度和灵敏度,以及低于共聚焦和其他超分辨成像方法(STORM/STED等)千分之一以上的光毒性和光漂白效应,成为了目前进行超长时间活细胞高速超分辨成像的利器。
而且,这个牛气哄哄的技术一经发明,便已经夺得生物成像领域的好几个“首次”:
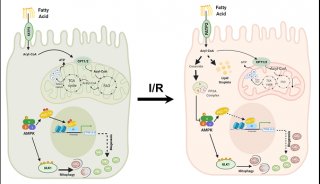
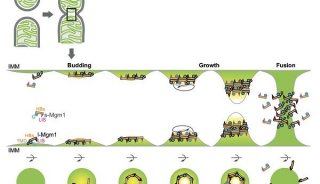
· 首次在活体细胞中清晰解析出线粒体的内膜结构,以及线粒体融合与裂解过程中内膜的动态变化;
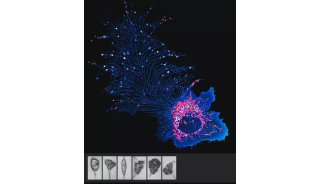
· 首次观察到活体细胞中线粒体嵴与内质网之间的相互作用与运动;
· 首次通过连续成像的形式,捕捉到了完整的囊泡分泌与融合过程中的孔道及融合中间态。
那么究竟这台高大上仪器是怎样被研发而出?它爆炸性的技能点具体又是怎样?接下来我们就来深度解读一下啦!
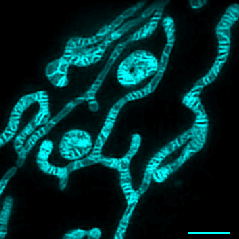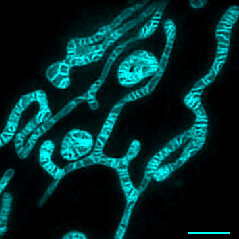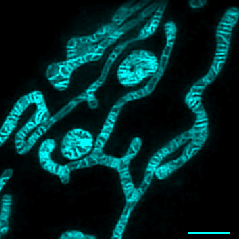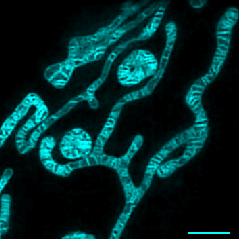
实时观察线粒体融合分裂及内膜动态变化
从1994年Stefen W. Hell提出STED显微镜理论,到2014年三位科学家因为超分辨显微技术获得诺贝尔化学奖。短短20年间,超分辨成像可以说是声名大噪,各种超分辨成像平台也几乎成为了各大高校研究所的必备。
但是,一个奇怪的现象让北京大学的陈良怡教授产生了疑惑:虽然遍地开花,但由超分辨成像技术所带来的生物学新发现却屈指可数。究竟是何种原因,限制了超分辨显微成像在生物研究领域大显身手?
目前,主流的超分辨成像技术主要有三类:
1、基于可随机开关的单分子荧光闪烁定位的STORM/PALM方法;
2、基于荧光蛋白受激发射损耗原理的STED方法;
3、基于结构光调制与解调制图像信息的SIM方法。
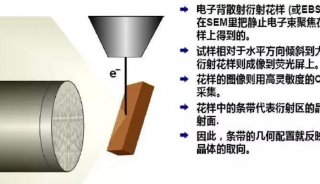
其中,STED通过纯光学方法能够获得50
nm甚至更低的分辨率,不通过算法拟合重建,成像速率取决于共聚焦平台的振镜扫描速率。但是其明显的弊端在于用于激发样品的光功率是最强的(MW/cm2数量级,相当于100万个太阳同时在天上炙烤你的皮肤)。如此一来,既会对样品产生积累的光毒性,又容易在长时间的活细胞观察过程中使样品荧光淬灭。
STORM/PALM相对于STED来说光照条件要稍微温和一些(kW/cm2数量级,大概也就相当于1000个太阳吧),分辨率也能到50
nm以下。但由于获得一张超分辨图片需要基于成百上千张原始的单分子闪烁图像,并通过算法拟合重建。所以成像的速度也是制约其发展的重要原因。同时,STORM/PALM对于荧光标记物的选择是非常苛刻的,因此几乎不能在同一个样品上实现多个蛋白的超分辨观察。
但是另外一种超分辨率方法,基于莫尔条纹效应的SIM就不一样了!
基于傅里叶光学和算法重建,SIM能够用最低的光功率(W/cm2数量级)获得长时间的活细胞超分辨图像。同时它对荧光标记物也无选择性,可以轻松实现多标记物观察。最重要的是由于重建一张超分辨图像只需要9-15张原始图像,因此SIM也是在相同成像视野下最快的超分辨方法。该方法非常适合生物样品中快速生物学过程的记录,如细胞内膜系统和细胞骨架的动态学研究、离子成像以及神经放电等等。
不过SIM也有一个明显的劣势——只能达到100 nm左右的分辨率。虽然使用非线性SIM成像可以使分辨率媲美其他两种方法,但代价则是需要使用很强的激发光,失去了活细胞观察的优势。
看准了SIM成像的优势,陈教授团队便开始着手进行线性SIM方法的优化。为了达到88 nm,188 Hz的优良性能,他们主要在以下几个方面做出了努力:
1、使用高NA的物镜,提升极限分辨率,尽可能多的接收光信号
提升成像系统的NA值一直是提高系统分辨率的不二法门。通过使用NA值高达1.7的油镜,再加上SIM方法本身的2倍分辨率提升,Hessian-SIM系统的最佳分辨率可以达到88 nm。

使用更高数值孔径的物镜可以明显提升光学系统的OTF,使其在傅里叶频域空间能探测更高频的信号。在二维的频域空间中,越靠近中央亮点的区域,代表图像越低频的部分,可以看到NA值越高越能覆盖到边缘的高频区域。
同时,NA值越大的物镜接受光信号的能力也越大,这样就可以最大限度降低激发光功率,或者使用尽可能短的曝光时间以期达到高速成像的目的。
-
科技前沿

-
焦点事件

-
项目成果

-
项目成果

-
焦点事件

-
焦点事件

-
企业风采

-
精英视角

-
产品技术

-
焦点事件

-
焦点事件

-
综述
-
科技前沿
-
科技前沿
-
焦点事件

-
产品技术
-
技术原理
-
技术原理
-
项目成果

-
焦点事件

-
实验室动态

-
技术原理

-
项目成果
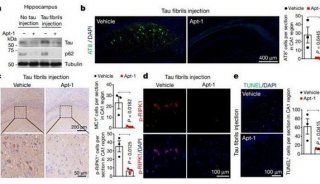
-
项目成果
-
项目成果
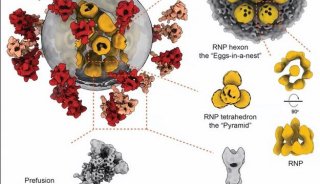
-
精英视角

-
焦点事件

-
焦点事件

-
项目成果
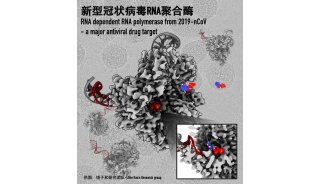
-
焦点事件
-
科技前沿
-
项目成果

-
项目成果
-
焦点事件
-
焦点事件

-
焦点事件