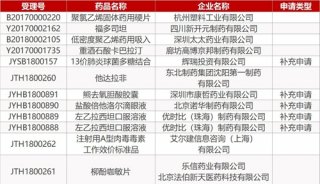
阿尔茨海默症:当前治疗及未来的挑战
很难相信,40年前,我们还认为阿尔茨海默症(AD)是由大脑中的铝导致的。出于对这种难缠疾病的恐惧,一些人甚至把自家的锅都扔了。目前,铝导致AD的假说已经没有太多人相信了,而与此同时,相关研究也在大踏步前进:1984年,研究者在AD患者的大脑中找到了β-淀粉样蛋白(Aβ);1986年,过度磷酸化的Tau蛋白也终未逃脱科学家们的法眼。这些才是真正的AD标记物,也是神经元死亡及记忆损害的潜在元凶。
淀粉样前体蛋白(APP)是制造Aβ的原料。1987年,研究者发现APP基因位于21号染色体上,另一危险基因APOE4也在1993年被确定。上世纪九十年代末期,人们发现β-分泌酶(BACE1)和γ分泌酶负责修剪APP,正是这一过程导致了Aβ的生成及脑细胞的死亡。随着新靶点的诞生,AD的治疗也逐渐有了头绪。
战壕中,与AD的斗争仍在继续。眼下的问题是,在这场战争中,我们所处的方位如何?我们就要大功告成,还是刚刚起步?3名AD领域的专家针对这一重要的议题进行了探讨。他们分别是杜克大学医院院的Murali Doraiswamy博士,埃默里大学的James Lah博士,以及布兰迪斯大学的Dagmar Ringe。
当前的AD治疗
Doraiswamy及其同事指出,我们已经可以针对受AD影响的脑神经递质开展治疗,比如升高乙酰胆碱水平(加兰他敏、利斯的明和多奈哌齐),或者阻断谷氨酸(美金刚)。这些药物可以在一定程度上延缓疾病进程,但不可否认,AD仍在持续进展中。Doraiswamy医生称:“目前,FDA已批准4种缓解AD症状的药物,这些药物对认知下降具有中度疗效。这些药中的某一些还可以联用,效果可能优于单药治疗。一些人认为,这些药同时可以减少患者所需照料时间及推迟进入疗养机构的时间。”
“我们有一条好消息和一条坏消息:好消息是,这一类药物中有很多已经不受ZL保护,价格不再像之前那样高不可攀;坏消息是,FDA已经有十年多未批准新的治疗手段了。”
Lah博士表示认同,称“目前的治疗选择过度局限,能用的都是一些对症状具有中等程度疗效的老药。”
三位博士均认为,早期治疗AD相当重要,甚至应尽可能在疾病进展之前进行干预。目前,很多AD治疗手段的目标即在于此。
Ringe博士指出:“事实上,目前尚无治愈AD的手段,我们也不清楚将来会不会有。我们并不在寻找针对进展期AD的治疗手段,我们所寻找的是针对潜在AD患者的治疗。”
Doraiswamy同意Ringe博士的观点,并指出:“所有针对预防AD的试验都失败了。然而,在‘哪些办法行不通’这个领域,我们积累了不少经验教训;同时,在确定高危患者及大脑变化的时间轴方面,我们也取得了巨大的进步。与十年前相比,我们对于大脑内哪些化学物质通路出了问题也有了更好的了解。我们需要加快进度,在AD病程全力开动之前,给药物提供一个施展疗效的舞台。”
Aβ疫苗
很多针对AD的临床试验都出了问题,这一状况自Aβ疫苗开始。小鼠AD模型显示,注射Aβ疫苗后小鼠的学习能力及记忆力有所改善,而脑内Aβ的水平也确实下降了。然而,由于安全性问题,人类Aβ疫苗被叫停。
Lah指出:“据我们所知,Aβ疫苗最严重的副作用就是脑水肿。2000年的试验之所以终止,这一副作用难辞其咎。”
尽管存在上述安全性问题,Aβ疫苗的研发仍在严谨的安全性监测下继续前进。比如,UB-311通过了一期临床试验,United Biomedical公司正将其作为疫苗研发。初始研究显示,使用该药物后,一小组轻度AD患者的认知功能得到了改善。CAD106是一种抗Aβ疫苗,由默克和Cytos共同研发。一项早期研究显示,该疫苗安全性良好,同时的确产生了相关抗体,但目前尚需更多试验以证明其有效性。
Lah探讨了其他抗淀粉样蛋白的治疗策略,尤其提到了单克隆抗体。这些药物通过静脉给药,数周给药一次。比如,辉瑞与强生合作研发的bapineuzumab并未达到临床试验主要终点,进一步的研发也终止了。礼来的Solanezumab在3期临床试验中也遭遇滑铁卢,然而,Lah也解释道,该药在事后分析中展现出了更大的潜力,在某些针对更早期AD患者的临床试验中或可展现获益。因此,一项预防性试验正在针对该药展开研究,基于遗传标记及脑影像,这项研究将确定该药疗效的潜在易感人群。他本人对Aβ抗体持乐观态度,理由是“如果更早使用,这些药物可能具有调控疾病的作用。”
除Aβ疫苗以外,还有一些治疗针对的是其他靶点,包括γ-分泌酶及BACE1。如前所述,上述两种酶可生成及释放Aβ。迄今为之,针对前者的临床试验无一成功:在人类试验中,γ-分泌酶抑制剂似乎不能降低Aβ水平。之所以出现这一状况,可能与这些药物不能稳定地通过血流进入大脑有关。
然而,BACE1抑制剂仍有希望。在2/3期临床试验中,默克研发的MK-8931达到了安全性要求,该研究所纳入的是轻到中度的AD患者。默克再接再厉,开展了一项3期APECS试验,该研究将测试MK-8931在AD早期患者中的疗效。然而,BACE1不仅影响Aβ,对其他靶点同样具有一定效应,可能导致副作用及安全性方面的问题,这也引发了一些关注。不过,MK-8931迈向3期临床试验本身就是成功。
β抑制剂
Tau蛋白过度磷酸化是AD治疗的另一个靶点。Lah博士指出:“已有前临床的工作显示,这一条路可能同样有效。”在前临床试验中,抗Tau药物埃博霉素B(Epothilone B)似乎可以减少小鼠神经元的死亡、AD样分子效应及认知问题。这种新型微管坚固剂可预防神经元微管的去稳定化,而后者正是Tau蛋白过度磷酸化的效应之一。该药目前正处于1期临床试验中。埃博霉素家族的其他成员也正处于相关研究之中。
增加神经营养因子
另一种具有潜力的AD治疗手段所针对的是神经营养因子(NGF),该物质可保护脑细胞。CERE-110是一种通过外科手段植入的非感染性病毒系统,可将NGF DNA注入大脑中,此举旨在增加NGF的生成。通过外科手术,CERE-110被植入Meynerti基底核,该脑区可生成乙酰胆碱,AD患者的这一脑区呈现退行性变化。1期临床试验显示,CERE-110耐受性良好。这一治疗手段正在接受2期临床试验。该试验纳入了大约50名AD患者,其中一半接受CERE-110治疗,另一半接受伪手术治疗,研究结果有望在2015年发布。
其他治疗手段
Doraiswamy博士介绍了其他治疗手段:“一些新的治疗手段正在研发中,如尼古丁递质调节疗法、诱导干细胞治疗、RNA干扰疗法、脑刺激疗法(直流电刺激、深部脑刺激)及基于代谢的疗法等。”研究者同样探讨了有氧运动及饮食疗法的作用。例如,杜克大学医学院所开展的ENLIGHTEN研究(the Exercise and NutritionaL Interventions for coGnitive and cardiovascular HealTh ENhancement)针对的正是上述干预措施对轻度认知功能损害患者的疗效。
retromer:AD治疗新靶点?
最近,《自然化学生物学》发表了一项振奋人心的研究,该研究对影响retromer复合体的药物进行了探讨。Retromer可推动包括APP在内的蛋白质从内涵体移动至高尔基体,以进行进一步的处理。与retromer相关的蛋白质可使APP及BACE1停留在内涵体,BACE1切割APP,导致Aβ的形成,而阻断这一进程可减少Aβ的生成。通过升高retromer的水平及推动正常的转运进程,我们有望预防AD。
研究者在人工培育的神经元中对化合物R55进行了测试。结果显示,retromer水平升高,Aβ则有所下降。接下来,研究者将在小鼠中测试R55的临床疗效。
Ringe是该研究的作者之一。她感觉,R55可能代表了一类副作用更小的治疗药物:“我们并没有试图过度调高或调低某一水平……我们只是将机体恢复至正常生理状态,使细胞回到正轨。”尽管该项研究仍处于早期阶段,在与AD的战争中,retromer有望为我们补充新的弹药。
2011年,奥巴马签署了“国家阿尔茨海默病计划法案”(National Alzheimer’s Project Act,NAPA),旨在于2025年之前研发出针对AD的有效疗法。看起来,战争仍将继续,但战略似乎已经尽收眼底。
-
焦点事件

-
企业风采

-
科技前沿

-
科技前沿

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件

-
市场商机

-
焦点事件

-
项目成果

-
项目成果
-
焦点事件

-
科技前沿

-
企业风采

-
项目成果

-
焦点事件

-
项目成果

-
焦点事件

-
科技前沿

-
焦点事件

-
会议会展

-
焦点事件
-
焦点事件

-
综述
-
科技前沿

-
科技前沿

-
焦点事件

-
会议会展

-
焦点事件

-
项目成果
-
焦点事件

-
技术原理
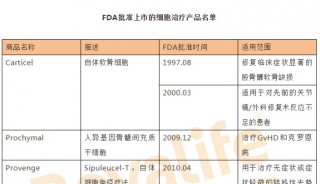
-
技术原理
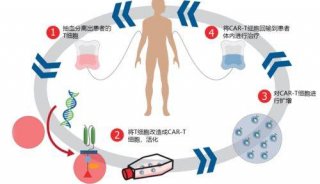
-
技术原理

-
焦点事件
-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
项目成果
-
焦点事件
-
焦点事件

-
焦点事件

-
科技前沿
-
科技前沿
-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件
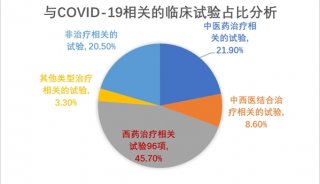
-
项目成果
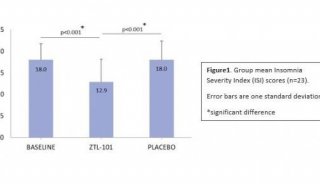
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件
-
项目成果
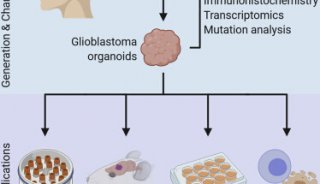
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
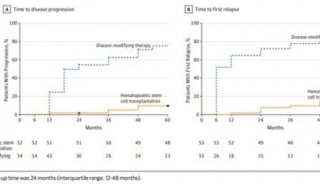
-
焦点事件
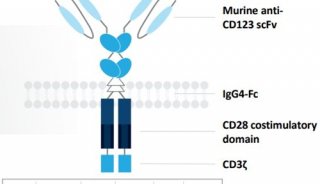
-
产品技术

-
焦点事件

-
并购

-
科技前沿

-
焦点事件
-
焦点事件
-
焦点事件

-
科技前沿

-
焦点事件

-
科技前沿
-
焦点事件

-
企业风采

-
科技前沿
-
综述
-
精英视角

-
焦点事件

-
项目成果
-
科技前沿

-
焦点事件
-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件