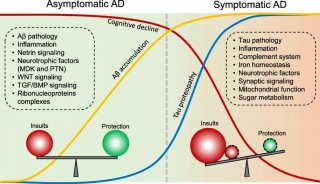
概述慢性特发性低钾血症的发病机制
慢性特发性低钾血症的发病机制尚未完全阐明。有人就本综合征发病环节提出4种假说:
1.血管壁对ATI的反应有缺陷导致肾素生成增多和继发性醛固酮增多。
2.近端小管钠重吸收障碍导致钠负平衡;低钠饮食亦不能逆转肾性失钾。
3.前列腺素生成过多,使肾小管失钠,血钠减低从而激活肾素-血管紧张素系统。
4.髓襻升支厚壁段对氯化物转输障碍,使氯化物重吸收减少,钾排泄增多导致低钾血症;低钾血症刺激前列腺素E2的生成,并使血浆肾素活肾素活性和血管紧张素Ⅰ升高。前列腺素E2升高后血管对ATI不敏感,因而血压正常。
近年来的临床与实验研究对Bartter综合征发病机制的认识有了很大的进展,认为Bartter综合征是由于髓襻升支厚壁段穿上皮细胞Cl-、Na 的转运障碍所致。目前对髓襻升支的几种离子通道蛋白的基因编码已经克隆出来,由于这些离子通道蛋白发生了丧失功能的基因突变,致使离子转运功能发生障碍。正常肾单位髓襻升支厚壁段对Cl-、Na 再吸收是由对布美他尼敏感的钠-钾-2氯运载体(bumetanide-sensitive sodium-potassium-2-chloride transporter,NKCC2)进行的。由于细胞内Na 与C1-较细胞外低,NKCC2将Na 、K 、2Cl-运转入细胞内,仍维持电中性。上皮细胞的基侧膜上有Na -K -ATP酶能把过多的Na 泵出细胞外,进入血液。另外,还有肾脏特异性基侧氯通道(kidney specific base lateral channel,CIC-kb)把Cl-泵出细胞外,经血液再吸收。髓襻升支厚壁段上的管腔膜上还有ATP调节钾通道(ATP-regulated potassium channel,ROMK)。NKCC2的转运速率是由ROMK对钾再循环进行调节,即ROMK为NKCC2提供有效的K 浓度,保证管腔的正电位。
基因研究推断,上述离子运载体蛋白或通道蛋白中任何一种发生突变,都可能出现离子转运障碍,从而导致Bartter综合征的发生。不同的通道蛋白或载体的缺陷可形成Bartter综合征的不同的亚型。目前认为,由于NKCC2功能丧失性突变,导致Na 、K 的再吸收障碍;ClCkb通道蛋白失活,限制了NKCC2运载体的转运速率,损害了K 的再循环过程对K 的再吸收。所以,只要上述环节中任何一种环节上发生了功能丧失性突变,都会削减上皮细胞电位差,减少上述离子重吸收的驱动力。
髓襻升支厚段再吸收Na 、Cl-减少,细胞外液量轻度降低,继发高肾素、高醛固酮血症和肾小球旁器增生与肥大。由于氯化钠大量流经集合管,刺激泌H 、泌K ,加上高醛固酮血症,因而引起低钾血症和代谢性碱中毒。肾素-血管紧张素-醛固酮系统功能亢进,促进激肽、血管舒缓素生成,前列腺素生成增多,使血管对血管紧张素反应降低,血压保持正常,无水肿表现。最近研究发现,Bartter综合征患者单核细胞NO合成酶(ecNOS)mRNA水平呈高表达,尿中NO代谢产物NO2-/NO3-与cGMP平行升高,推测由于NO产生增多,减少血管张力,认为也是Bartter综合征患者血管对血管紧张素反应性降低的原因之一。有关ecNOS在Bartter综合征发病机制中的作用,尚需深入研究。
-
综述