逆转录PCR(RT-PCR)
1.了解用逆转录PCR 法获取目的基因的原理。
2.学习和掌握逆转录PCR 的技术和方法。
【实验原理】
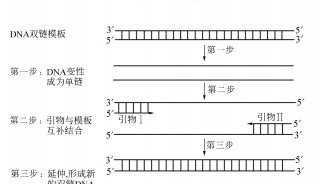
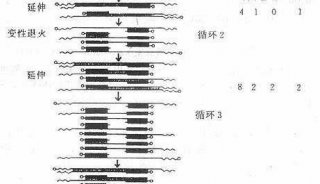
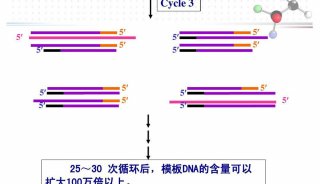
聚合酶链式反应(PCR)过程利用模板变性,引物退火和引物延伸的多个循环来扩增DNA序列。因为上一轮的扩增产物又作为下一轮扩增的模板,是一个指数增长的过程,使其成为检测核酸和克隆基因的一种非常灵敏的技术。一般经25-35轮循环就可使模板DNA扩增达106 倍。RT-PCR将以RNA为模板的cDNA(complement DNA)合成(即RNA的反转录(RT,reversetranscription)),同cDNA的PCR结合在一起的技术,提供了一种基因表达检测、定量和cDNA克隆的快速灵敏的方法。由于cDNA包括了编码蛋白的完整序列而且不含内含子,只要略经改造便可直接用于基因工程 表达和功能研究,因此RT-PCR成为目前获得目的基因的一种重要手段。
RT-PCR 技术灵敏而且用途广泛,可用于检测细胞中基因表达水平、表达差异,细胞中RNA病毒的含量和直接克隆特定基因的cDNA序列。RT-PCR比其他包括Northern印迹、RNase保护分析、原位杂交及S1核酸酶分析在内的RNA分析技术,更灵敏,更易于操作。
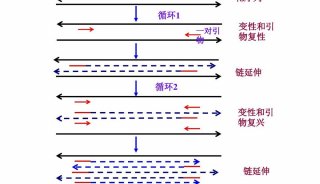
RT-PCR的基本原理(图4.1)。首先是在逆转录酶的作用下从RNA合成 cDNA,即总RNA中的mRNA在体外被反向转录合成DNA拷贝,因拷贝DNA的核苷酸序列完全互补于模板mRNA,称之为互补DNA(cDNA);然后再利用DNA聚合酶,以cDNA第一链为模板,以四种脱氧核苷三磷酸(dNTP)为材料,在引物的引导下复制出大量的cDNA或目的片段。
在RT时,有3种引物可选择 (表4.1) 。用1)和2)方法,理论上是扩增的所有的cDNA,还要用此产物做PCR的模板继续扩增。如果用3)方法,先要去http://www.ncbi.nlm.nih.gov查它的序列,并用oligo等软件设计引物。
RT-PCR可以一步法或两步法的形式进行。两步法RT-PCR比较常见,在使用一个样品检测或克隆多个基因的mRNA时比较有用。在两步法RT-PCR中,每一步都在最佳条件下进行。cDNA的合成首先在逆转录缓冲液中进行,然后取出1/10的反应产物进行PCR。而一步法RT-PCR具有其它优点(表4.2),cDNA合成和扩增反应在同一管中进行,不需要打开管盖和转移,有助于减少污染。还可以得到更高的灵敏度,最低可以达到0.1pg总RNA,因为整个cDNA样品都被扩增。对于成功的一步法RT-PCR,一般使用基因特异性引物(GSP)起始cDNA的合成。
由图4.1不难看出,随机引物法是三种方法中特异性最低的。引物在整个转录本的多个位点退火,产生短的,部分长度的cDNA。这种方法经常用于获取5"末端序列及从带有二级结构区域或带有逆转录酶不能复制的终止位点的RNA模板获得cDNA。为了获得最长的cDNA,需要按经验确定每个RNA样品中引物与RNA的比例。随机引物的起始浓度范围为50到250ng每20μl反应体系。因为使用随机引物从总RNA合成的cDNA主要是核糖体RNA,所以模板一般选用poly(A)+RNA。
Oligo(dT)起始比随机引物特异性高。它同大多数真核细胞mRNA 3"端所发现的poly(A)尾杂交。因为poly(A)+RNA大概占总RNA的1%到2%,所以与使用随机引物相比,cDNA的数量和复杂度要少得多。因为其较高的特异性,oligo(dT)一般不需要对RNA和引物的比例及poly(A)+选择进行优化。建议每20μl反应体系使用0.5μg oligo(dT)。oligo(dT)12-18适用于多数RT-PCR。
基因特异性引物(GSP)对于逆转录步骤是特异性最好的引物。GSP是反义寡聚核苷,可以特异性地同RNA目的序列杂交,而不象随机引物或oligo(dT)那样同所有RNA退火。用于设计PCR引物的规则同样适用于逆转录反应GSP的设计。GSP可以同与mRNA 3"最末端退火的扩增引物序列相同,或GSP可以设计为与反向扩增引物的下游退火。
已经制备好的双链cDNA和一般DNA一样,可以插入到质粒或噬菌体中,为此,首先必需有适当的接头(Linker),接头可以是在PCR引物上增加限制性内切酶识别位点片段,经PCR扩增后再克隆入相应的载体;也可以利用末端转移酶在载体和双链cDNA的末端接上一段寡聚dG和dC或dT和dA尾巴,退火后形成重组质粒,并转化到宿主菌中进行扩增。
本实验是要从小鼠肝脏组织中获取Fas配体基因,Fas配体(FasL)是一分子量约为40u的II型跨膜糖蛋白,属TNF家族成员。活化的T细胞可表达Fas和FasL,并通过Fas/FasL系统介导细胞凋亡作用,保持机体免疫系统的自稳态。近年研究发现在部分癌细胞中FasL表达增强,并与肿瘤的复发转移有关。我们采用RT-PCR方法克隆FasL全长cDNA并构建其表达载体,可以为进一步研究FasL的功能提供条件。在上下游引物的5’端分别加上了限制酶切位点及其保护碱基(即Hind III和BamH I),以便可以通过双酶切将目的片段定向的克隆到原核表达载体pGFPUv上(附录图4.3)。
为了便于后续实验可以用金属螯和层析的方法分离和纯化目的蛋白,我们改造了pGFPUv,在其上加了6×His标签。
【试剂与器材】
(一)试剂
1.总RNA(或mRNA)
2.RNA酶抑制蛋白(RNase Inhibitor) :40 U/mL
3.dNTP 混合物 (各10 mM)
4.oligo(dT)12-18:2.5 ?mol/L
5.10*逆转录合成缓冲液(10?RT buffer):250 mmol/L Tris-HCl (pH8.3),375 mmol/L KCl,15 mmol/L MgCl2
6.AMV逆转录酶 5u/?L
7.基因特异性5’和3’引物各20 ?mol/L
8.Tap DNA聚合酶 5u/?L
9.10*PCR缓冲液:500mmol/L KCl,100mmol/L Tris•Cl,在25℃下,pH9.0,1.0% Triton X-100,15mmol/L MgCl2。
(二)器材
1)PCR仪,
2)PCR管,
3)微量移液器
【操作方法】
(一)逆转录:
1)建立RT反应体系:
2)涡旋混匀,42℃反应1小时,95℃加热5分钟,然后置于冰上。
(二)PCR扩增:
1)建立PCR反应体系:
2)将上述反应体系涡旋混匀, 按下列程序运行循环:
step2-4运行30个循环,其中复性温度主要依据引物的不同而不同。
(三)取10-20uL PCR产物进行琼脂糖凝胶电泳检测,余下的PCR产物-20℃保存。
【注意事项与提示】
1.逆转录反应过程,需建立无RNAase环境,以避免RNA的降解。
2.成功的逆转录反应决定于高质量的模板RNA。高质量的RNA至少应保证全长并且不含逆转录酶的抑制剂,如EDTA或SDS。此外,RT-PCR所遇到的一个潜在的困难是RNA中沾染的基因组DNA。使用较好的RNA分离方法,如Trizol Reagent,会减少RNA制备物中沾染的基因组DNA。因此在进行PCR反应时应该对每个RNA模板进行一个无逆转录的对照反应,以确定扩增出来的片段是来自基因组DNA还是cDNA。在无逆转录时所得到的PCR产物来源于基因组。
3.RT-PCR的起始模板可是总RNA或mRNA,都可以检测到扩增结果(如下图)。另外,分离mRNA会导致样品间mRNA丰度的波动变化,从而使信息的检出和定量产生偏差。然而,当分析稀有基因时,使用mRNA会增加检测的灵敏度。
4.在逆转录反应中经常加入RNA酶抑制蛋白以增加cDNA合成的长度和产量。RNA酶抑制蛋白要在第一链合成反应中,在缓冲液和还原剂(如DTT)存在的条件下加入,因为cDNA合成前的过程会使抑制剂变性,从而释放结合的可以降解RNA的RNase。RNA酶抑制蛋白仅防止RNase A,B,C对RNA的降解,并不能防止皮肤上的RNase,因此尽管使用了这些抑制剂,也要小心试验者的手上Rnase对样品的污染。
5.较高的保温温度有助于RNA二级结构的打开,增加了反应的产量。对于多数RNA模板,在没有缓冲液或盐的条件下,将RNA和引物在65℃保温,然后迅速置于冰上冷却,可以消除大多数二级结构,从而使引物可以结合。然而某些模板仍然会存在二级结构,即使热变性后也是如此。对这些困难模板的扩增可以使用经过改良的耐高温逆转录酶, 如:Invitrogen 公司的ThermoScript逆转录酶,使逆转录反应置于较高温度下进行以改善扩增。而且适当提高逆转录保温温度,可增加RT-PCR的特异性。
6.建立反应体系时,加完其它反应物后,才加模板DNA和Taq DNA聚合酶;然后将全部反应物涡旋混匀;上PCR仪前加矿物油封盖或设热盖。
7.PCR反应的循环数一般25-30次就足够了,过多的循环数会造成非特异性扩增和时间的浪费。复性温度的计算,一般是在引物的Tm值上下浮动,Tm =2(A+T)+4(G+C)。适当提高复性温度可提高PCR扩增的特异性。
8.不管是反转录反应还是PCR反应都应先调制试剂的Master Mix (包括RNase Free dH2O、缓冲液、dNTP Mixture等),然后分装到每个反应管中。这样可使所取的试剂的体积更准确,减少试剂的损失,避免重复分取同一试剂,同时也可以减少实验操作造成的误差。而且分装试剂时务必用新Tip,以防止样品间的污染。
9.AMV、RNase Inhibitor、Taq等酶类,要轻轻地混匀,避免起泡。分取之前要轻轻地离心收集到反应管底部,因其粘度高,所以要慢慢地分取。 酶类务必在实验前从-20℃取出,使用后立即放回-20℃保存。
10.最佳的PCR条件,因PCR扩增仪的不同而不同,所以在使用您的样品之前最好先做Control反应,以确定最佳的PCR条件。为延长PCR仪的使用寿命,应尽可能缩短PCR仪4℃保存的时间,尽量避免4℃过夜的情况。
Lane 1:总RNA 的 RT-PCR 产物(人细胞调亡因子TF15基因)
Lane 2: mRNA 的 RT-PCR 产物,人细胞调亡因子TF15基因
Lane 3: 100bp marker
【实验安排】
1.第一天:试剂的配制和所用一次性塑料制品和玻璃器皿的去RNase处理(0.1%DEPC浸泡或高温干烤)。
2.第二天:进行(一)逆转录和(二)PCR扩增。
3.第三天:进行(三)琼脂糖凝胶电泳检测。
4.为了保证实验质量,最好能将总RNA提取、mRNA的分离纯化、RT-PCR和cDNA文库构建实验安排在连续的时间内进行。
【实验报告要求与思考题】
1.RT-PCR产物琼脂糖凝胶电泳结果;
2.如何提高RT-PCR的灵敏度和特异性?
-
综述
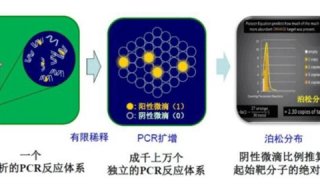
-
焦点事件
-
焦点事件

-
项目成果
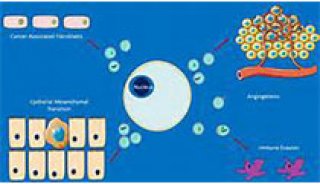
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
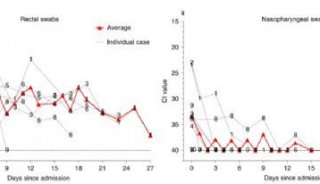
-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件