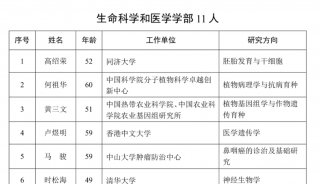
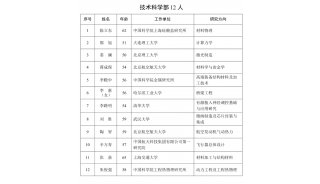
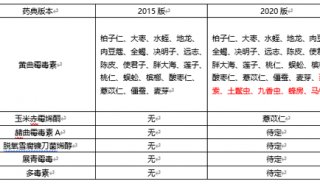
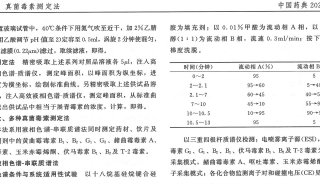
2010年版《中国药典》要点解读
2010年版《中国药典》为新中国药典的第九版,已于2009年底印刷出版,定于2010年7月1日正式实施。新版药典在很多方面有了改进和提高。本文将就其中的几个要点进行解读,以飨读者。
2010年版《中国药典》为新中国药典的第九版,已于2009年底印刷出版,定于2010年7月1日正式实施。2010年版药典编制工作启动时间较晚,但安排的科研项目是历来最多的,其时间紧、任务重、要求高、责任大,是新版药典制定工作的最大特点。和2005年版药典相比,2010年版药典主要特点如下。
充分借鉴和利用国内外药品标准的相关资源
遵循继承、发展与创新相结合的原则,在增修订工作中,新版药典以历版中国药典为基础,充分吸收美国药典、英国药典等国外先进药典的相关内容,在总体上有了系统性的全面提高。在化学药方面,加快了与国外先进药典标准的逐步接轨,使中国药品标准的安全和质量可控性与国际先进标准逐步接轨。在中药方面,加强中药标准化建设,不断完善技术标准体系,探索建立中药材来源、生产工艺和检测指标相结合的质量控制模式;加强药品标准物质的研制及其标定,建立国家中药标准物质库。在生物制品方面,为切实保障生物制品质量安全,以规范生物制品生产、工艺验证、过程控制为重点,加强对生物制品的原辅料的质量控制指标;完善生物制品检测方法等,提高了产品的有效性和安全性指标。
在重视传承和借鉴基础上,新版药典更注重创新和发展,充分地体现了保持标准先进性的原则,进行了大幅度的标准修订和新增收品种标准的工作,在质量控制指标方面有了全面的提高。除此,在凡例、正文、附录等方面也均有整体性改进、较大的发展和提高,特别是药品的安全性、有效性和质量可控性方面有了明显地提高。
收载品种大幅增加
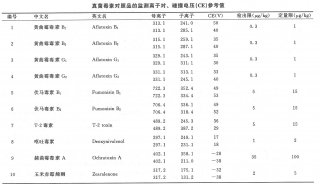
新版药典积极扩大了收载品种范围,基本覆盖了《国家基本药物目录》品种范围。新版药典收载品种总计4567个,其中新增品种1386个;药典一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;药典二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;药典三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。收载品种的新增幅度达43%,修订幅度达10%,均为历版最高,尤其是重点解决了长期以来中药材饮片和常用药用辅料国家标准欠缺和不足的问题。
提高药品标准就意味着存优去劣。一批临床不用、已经淘汰或质量不可控、存在安全隐患的品种已从新版药典中撤出。据统计,2005年版收载而新版药典未收载的品种共计36种,逐步形成《中国药典》收载品种新增与退出机制。
新版药典重视民族药标准的提高和完善,新增民族药药材标准8个,成药标准5个,并在注重民族药基源调查和整理的基础上,对2005年版药典收载的民族药标准普遍进行了修订提高。
扩大现代分析技术的应用
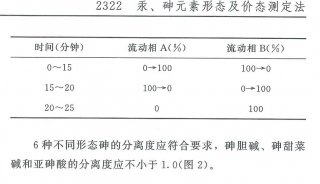
坚持科学、实用和规范相结合、坚持保持标准先进性的原则,新版药典在广泛吸取国内外先进技术和实验方法的基础上,积极推进药物分析新方法、新技术在药品标准中的应用,例如,在附录中增加了新技术方法的收载,新增离子色谱法,核磁共振波谱法、拉曼光谱法等,力求与国外药典控制药品质量的方法和技术基本一致。在重视基础性、系统性研究,强化中药材、中药饮片的标准发展与提高方面,采用了液相色谱-质谱联用技术、DNA分子鉴定、薄层生物自显影技术等新技术和方法,以提高分析灵敏度和专属性,解决常规分析方法无法解决的问题。化学药品标准中首次采用了分离效能更高的离子色谱法和毛细管电泳法;总有机碳测定法和电导率测定法被用于纯化水、注射用水等标准中。生物制品部分品种采用了体外方法替代动物试验用于生物制品活性/效价测定,采用灵敏度更高的病毒灭活验证方法等。
加强药品的安全性保障
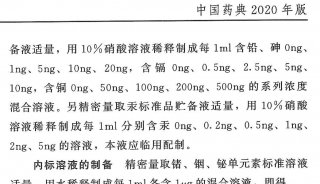
针对人民群众反映强烈的药品安全问题,以提高药品质量、维护公众健康为原则,新版药典在着重提高产品的标准,建立准确、精密、专属和完善的检测方法的基础上,进一步提高了对高风险品种的标准要求,加强中药、生化药品,以及注射剂等高风险品种安全性质量控制,在“凡例”和“附录”中加强安全性检查总体要求外,品种正文标准中也大幅度增加或完善安全性检查项目。例如,在附录中新增溶血与凝聚检查法、抑菌剂效力检查法指导原则,制剂通则中规定眼用制剂按无菌要求等。在一部中,对中药注射剂增加重金属和有害元素限度标准;对用药时间较长、或儿童常用的药品及常用硬胶囊增加重金属和有害元素检查;对易霉变的中药材及饮片等新增黄曲霉毒素检测。在二部中加强了对有关物质、高聚物等的控制;扩大对残留溶剂、抑菌剂与抗氧剂、渗透压、细菌内毒素、无菌等的控制。在三部中,严格控制了生物制品生产过程中抗生素的使用,对添加防腐剂进行了限制,并加强对残留溶剂、杂质、内毒素残留等控制要求。
特别是对于各类注射剂,新版药典增加了一些确保安全性的原则性要求:一是注射剂所用的原辅料应从来源及工艺等环节上进行严格控制并应符合注射用的质量标准;二是静脉输液应与血液等渗;三是供注射用的非水性溶剂,应严格限制用量并在品种项下进行相应的检查;四是注射用容器应足够透明,以便内容物的检视;五是必要时,注射剂应进行相应的安全性检查并符合要求,如异常毒性、过敏反应、溶血与凝聚、降压物等;六是注射剂所用辅料在标签说明书中应标明其名称。
提升药品的质量可控性保障
为提高药品的质量可控性,新版药典除在附录中新增和修订相关的质量控制的检查方法和指导原则外,在品种正文标准中增加或完善安全性、有效性和质量可控性的检查项目。如附录新增电感耦合等离子体原子发射光谱法,修订了原子吸收光谱法、重金属检查法等,组成较完整的控制重金属和有害元素的检测方法体系。在一部中,大幅度增加符合中药特点的专属性鉴别,除矿物药外均有专属性强的薄层鉴别方法,建立了与质量直接相关,能体现有效活性的专属性检测方法,在中药注射剂标准中,增加了基于色谱指纹图谱的检查指标。在二部中,大幅度增订溶出度、含量均匀度等检查要求,增加有关物质和溶剂残留等检查项目。在三部中,对原材料质量要求更加严格,对检测项目及方法的确定更加科学合理。
无论是在一部或二部标准中,一些操作繁琐、精密度差,结果欠准确的含量测定方法被专属性强、准确性高,精密度好的高效液相色谱法所取代,仅中药材和饮片含量测定品种中新增高效液相色谱法就有412项。此外,“一标多测”的方法在中药标准中多成分含量测定中得到应用。
为了保证药品的整体质量,新版药典对药品辅料安全标准进行了大幅提高,扩大收载常用辅料的范围,严格辅料特别是注射用辅料的标准要求。
药品标准内容更趋科学、规范、合理
科学、实用和规范相结合的原则,在新版药典编制过程中得到了认真的贯彻。在附录中规范了剂型定义和检查要求外,在正文中,对品种标准进行统一规范,同一品种的标准的制定坚持做到“就高不就低”。例如,在制剂通则中新增了药用辅料总体要求;可见异物检查法中进一步规定抽样要求、检测次数和时限;不溶性微粒检查法操作方法进行了进一步统一,对一些技术规定力求具体、严格和规范,如在片剂中修订了含片的溶化性,对固体制剂的崩解时限有了更为明确严格的规定。在一部中规范和修订了中药材拉丁名,以与国际通行的表述相一致;明确入药者均为饮片,从标准收载体例上明确了“性味与归经”、“功能与主治”、“用法与用量”为饮片的属性,对收载于药典的标准力求齐全、合理、实用、有效。
鼓励技术创新,积极参与国际协调
新版药典坚持继承、发展与创新相结合的原则,积极鼓励技术创新,以加快与国际药品标准接轨的步伐,提高我国药品的国际竞争力。同时,鼓励使用快速检测设备和手段,增强药品标准的实用性和可操作性。
在中药方面,努力将我国中医药优势技术提升为国家标准,根据中医学理论和中药成分复杂的特点,积极研究并引入能反映中药整体特性的“一测多评”方法、色谱特征图谱和指纹图谱等有效的质量控制方法,力求反映中药内在质量整体变化情况,以保障药品质量的稳定性和均一性。
在化学药方面,积极引入ICH在药品杂质控制、无菌检查法等方面的要求和限度,部分品种的控制指标与欧美药典一致,有些品种标准已优于欧美药典。
此外,强调要求并充分体现野生药材资源保护与中药可持续发展的理念,依据相关国际公约,明确不再增收濒危野生药材,从国家标准角度,积极引导并支持人工种养药材的产业化发展。坚持以人为本,积极倡导绿色标准,鼓励并积极推行采用毒害小、污染少、有利于节约和综合利用资源、保护环境、简便实用的检测技术和方法。
综上所述,新版药典在充分借鉴国内、国际先进技术和经验的基础上,在确保科学性、规范性和前瞻性的前提下,着力解决了制约药品质量与安全的突出问题,着力提高药品标准质量控制水平;充分反映了当前医药工业、临床用药及检验技术发展实际水平,对于提高我国药品质量标准的全面提高将起到积极而重要的推动作用。
-
政策法规

-
标准

-
标准

-
焦点事件

-
标准

-
标准

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
标准

-
焦点事件

-
标准

-
焦点事件

-
焦点事件
-
标准

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
标准

-
焦点事件
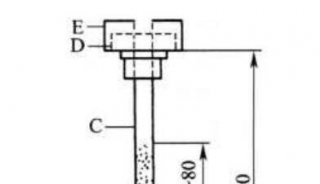
-
标准

-
标准
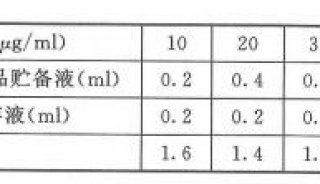
-
标准
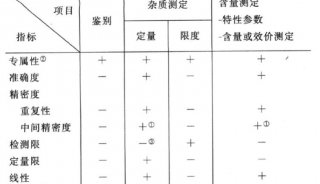
-
标准
-
焦点事件

-
焦点事件

-
焦点事件

-
政策法规

-
焦点事件
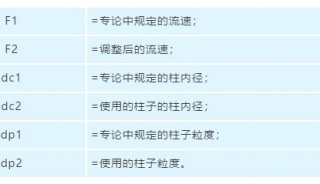
-
焦点事件

-
财报

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
标准

-
标准

-
标准

-
标准

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
标准

-
会议会展

-
会议会展
-
会议会展

-
焦点事件

-
标准
-
焦点事件

-
焦点事件

-
焦点事件

-
技术原理

-
焦点事件

-
焦点事件
-
标准

-
标准

-
焦点事件

-
焦点事件

-
焦点事件

-
政策法规

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
政策法规

-
焦点事件

-
焦点事件