基因组DNA文库构建必备实验技巧-2
技术支持资料:
材料
缓冲液和溶液
- 碱裂解液I , 4°C
50 mM 葡萄糖
25 mM Tris-Cl (pH 8.0)
10 mM EDTA (pH 8.0)
配制碱裂解液I 约100ml,灭菌,保存在四度。
- 碱裂解液II,新鲜配置,室温保存
0.2 N NaOH (从10N的NaOH新鲜制备)
1% (w/v) SDS 碱裂解液II应该新鲜配制,室温保存。
- 碱裂解液III, 4°C
5M 醋酸钾,60ml
冰醋酸,11.5ml
SDW,28.5ml - 酒精
- 70%酒精 - 异丙醇 - 酚:氯仿(1:1, v/v)
- 醋酸钠 (3M,pH5.2)
- STE,4°C
10 mM Tris-Cl (pH 8.0)
0.1 M NaCl
1 mM EDTA (pH 8.0)
- TE (pH 8.0)
10 mM Tris-Cl (pH 8.0)
10 mM EDTA (pH 8.0)
载体与菌株 BAC转化的大肠杆菌
培养基和抗生素 含12.5μg/ml氯霉素的LB平板和液体培养基
酶和缓冲液
溶菌酶
RNaseA,不含DNase
限制性内切酶和相应缓冲液
核苷酸/寡核苷酸
用于脉冲场凝胶电泳(pulsed-field gel electrophoresis)的DNA
标准参照物
凝胶/点样缓冲液
脉冲场凝胶电泳(Pulsed-field gels,或者0.5%琼脂糖凝胶) 离心机/转头/离心管
其他 37摄氏度摇床
1.BAC DNA大量提取方案 (参考文献:Molecular cloning: A Laboratory Manual Third Edition)
此方案适合从500ml的菌液中提取BAC DNA,一般可以产生20-25μg纯化的DNA。
方法
1.将50μl BAC转化菌的过夜培养物接种到500ml含12.5μg/ml氯霉素的LB液体培养基中,37℃ 震荡(280rpm)培养12到16小时。
2.2500g,4℃,离心15min,收集菌体。
3.用100ml冰预冷的STE重新悬浮细菌沉淀。按步骤2方法离心收集细菌。
4.用24ml含RNase(100μg/ml)的碱性裂解液I溶解细菌。加溶菌酶至终浓度为1mg/ml。
5.加入24ml新鲜配置的碱性裂解液II。盖紧离心瓶盖,轻轻翻转瓶子数次,使内容物完全混匀,冰裕5min。
6.加入24ml冰预冷的碱性裂解液III,盖紧瓶盖,轻轻翻转瓶子数次,使内容物完全混匀,置冰上5min。
7.15000g,4℃,离心10min,将上清转移到另一离心瓶中,弃沉淀。
8.加等体积的酚:氯仿。轻轻翻转离心瓶数次,混匀。3000g,室温离心15min。
9.将水相移至另一离心瓶中,加入等体积的异丙醇,翻转离心瓶数次,混匀。
10.15,000g,室温离心15分钟,回收核酸沉淀。
11.弃上清,用20ml 70%乙醇漂洗沉淀。
12.弃乙醇,风干使乙醇挥发殆尽。
13.小心将BAC DNA沉淀溶于0.2ml TE (pH8.0) 中。
2.BAC DNA的小量提取 (参考文献:Molecular cloning: A Laboratory Manual Third Edition)
此方案适合从5ml菌液中提取BAC DNA,一般可以产生0.1-0.4μg的BAC DNA。
方法: 1.挑取单菌落接种至5ml含12.5μg/ml氯霉素的LB培养基中,37℃剧烈震摇过夜。
2.2000g,4℃,离心5min,收集菌体。
3.在每个离心管中加5ml预冷的STE,用移液器吹悬细菌沉淀。按步骤2离心收集细菌。
4.将菌体重悬于200ul冰冷的碱性裂解液I中。将菌体转移至预冷的微量离心管中,置于冰上。
5.向管中加入400μl新鲜配置的碱性裂解液II。轻轻翻转数次,将离心管置于冰上。
6.向管中加入300μl冰冷的碱性裂解液III,轻轻翻转数次。将离心管置于冰上5min。
7.在微量离心机上以最大速度4℃离心5min,除去细胞碎片沉淀。将上清移入一新的微量离心管中。室温下加入900μl异丙醇,轻轻翻转数次离心管,混匀。
8.立即在微量离心机上室温下最大速离心5min,使核酸沉淀。弃去上清,用1ml 70%乙醇小心漂洗。室温下离心2min,吸去乙醇。室温干燥沉淀5-10min后,将沉淀溶于50μl TE(pH8.0)中.
-
企业风采

-
企业风采

-
焦点事件

-
项目成果
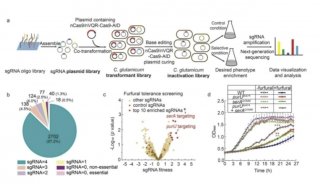
-
科技前沿
-
焦点事件

-
项目成果
-
科技前沿
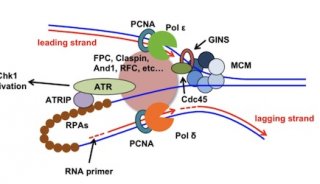
-
科技前沿

-
焦点事件

-
实验室动态