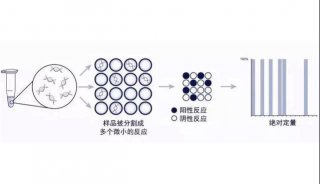
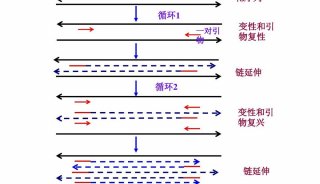
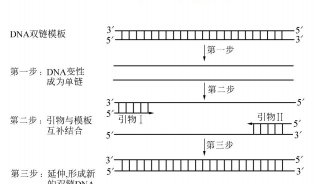
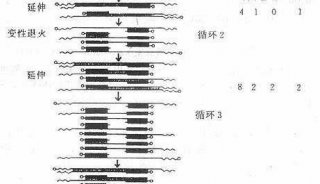
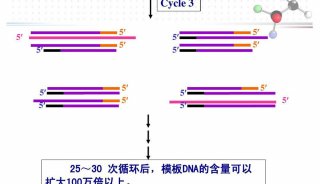
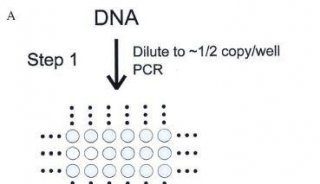
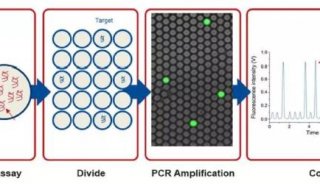
用PCR进行基因分型
与许多一次做数百块Southern blots的研究人员一样,我第一次用PCR做基因分型(genotyping)时觉得见效很快,不再需要等几天才能看到结果,不再需要DNA显微图像或者操作紫外线了。随着技术的不断进步,RCR使基因组学和转录组学发生了翻天覆地的变化,甚至随着免疫PCR的普及开始进军蛋白组学。
目前有许多以RNA为基础的基因分型技术,有些只是名称不同,简单到只是跑块胶,有些很复杂,需要检测单核苷酸多态性的累积。选择哪种方法当然依据需要而定,但这里对某些以PCR为基础的基因分型分析的优点和缺点做了一个简要总结。下标列出了一些常见的系统和平台及其详细特征。
The Simple Acronyms
最基本的设计是序列特异引物(sequence-specific primers ,SSP )或称等位基因特异性引物延伸(allele specific primer extension ,ASPE)、序列特异性寡核苷酸探针(sequence-specific oligonucleotide probes,SSOP)或等位基因特异性寡核苷酸(allele-specific oligonucleotides ,ASO)、限制性片段长度多态性分析(restriction fragment length polymorphism,RFLP)。进行低通量研究时,这些分析不需要特异仪器。
一般情况下,SSP中变的异体专一引物所检测的特异突变或者是positive 或者是negative;在SSOP中,将标记过的扩增子(amplicon)绑定在位于杂交斑点上的变异体专一探针,检测突变;RFLP中,用限制性内源性降解PCR产物,通过观察切开或者未切开片段,得到结果。尽管突变的位点对SSP设计引物有限制,但SSOP和RFLP为引物设计带来了很大弹性,引物可以在任何地点,尝到甚至可以跨越突变。
我还发现RFLP(又称扩增片段长度多态性,amplified fragment length polymorphism,AFLP)得到明确结果,鉴别突变有合适和和便宜的核酸内切酶。加入标记过的引物,大多数遗传分析仪可推算片段长度。问题在于它需要post-PCR操作,意味着污染的风险,而且也不适合高通量研究。
对于大项目,所有三种方法都很昂贵和耗时,但因为大多数自动化方法要求扩增小片段,基本的设计是分析大片段的唯一选择。而且,有旁向性同源基因(paralogs)的基因需要具有位点特异性的引物。假如目的突变和位点特异的引物相距较远,基本方法是必需的。
熔解曲线法
DNA的碱基组成影响变性温度。利用特异荧光染料或者标记探针的高分辨率熔解点分析能够在PCR(标准设备上)进行5~10分钟后鉴别一个PNA片段上的寡核苷酸突变,所需的专用设备包括Idaho Technology公司的LightScanner(或HR-1)和罗氏的LightTyper,但某些实时PCR平台也有这种功能。
该方法还可用于检测新突变和未知突变,专用设备能够在短时间内分析384孔平板,使高通量分析成为可能。至少可以区分一个片段的4种熔解温度,用六种颜色标记探针。因此,至少一次能够探测24个靶标,因此这种方法很便宜,而且对引物设计没有要求,系统始终处于封闭的管中,降低了污染风险。一些变异在低分辨率平台中会丢失,但这种方法有望成为最流行的筛选和检测突变的方法。
焦磷酸测序(Pyrosequencing)
多种引物延伸和以连接为基础的化学法已经整合入久经考验的“allelic discrimination”的高通量分析法中。焦磷酸测序法(Pyrosequencing)是一种新的实时DNA测序技术,以单碱基延伸反应(single base extension,SBE)为基础,在DNA 聚合酶、三磷酸腺苷硫酸化酶、荧光素酶(luciferase)和三磷酸腺苷双磷酸酶4种酶的协同作用下,使引物延伸聚合脱氧核糖核酸(dNTP)释放焦磷酸盐(PPi)、PPi转换三磷酸腺苷(ATP)、ATP产生荧光信号与dNTP和ATP的降解等化学反应偶联起来。dNTP以预定顺序被依次加入反应混合物中,如果序列上又添加了一个碱基,会有荧光出现。焦磷酸测序法能够一次检测384个样本,在所有引物延伸反应中,对引物设计有限制。
焦磷酸测序最适合于空间位置较近的多个突变的基因分型,但不适合检测单个突变,部份原因是实验程序稍微复杂,而且会增加在酶和试剂上的开销。然而,对拥有自动genotype-calling能力的小或者中等大小的项目来说是一种恰当的基因分型和微型测序法。
悬浮点阵技术(suspension array technology)
一项液相基因型分析方法和荧光标记的微珠捕获过程相结合的新技术。在单碱基延伸反应中,5’端有特定标记且3’端有靶特异性的寡核苷酸,与PCR扩增的基因组DNA靶标杂交,然后被DNA聚合酶延伸。核酸探针经过生物素标记,微珠经过抗生素(生物素和抗生素相互作用)标记。然后用血细胞计数工具——Luminex分析仪分析微珠。
每个微珠都是某个单突变的聚集点,如果有突变,便会发射生物素-抗生物素蛋白产生的单色荧光。以珠子为基础的平台与单碱基延伸、引物延伸、杂交和寡核苷酸连接反应能够达到相同的功效。Luminex发明了悬浮点阵技术,能够进行数百套检测,因此经过PCR扩增后,能够在一个孔中对50个二等位基因(biallelic)突变进行基因分型,使其对大量突变特别是HLA或者MICA中的单基因突变研究效果更佳。多路技术降低了分析成本,但优化多元反应也很困难。
质谱法
原则上,添加到引物末端的核苷能够直接依据质量,利用通过基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectroscopy,MALDI-TOFMS)直接检测出来,这是一种不需标记的方法。单碱基延伸产物质谱结果能够显示所添加的核苷。
MALDI-TOFMS需要大型设备,但因为高度多路技术和高通量分析,这种方法的成本只为0.03美元/单突变,只是备的成本限制了其普及。MALDI-TOFMS还能实现利用非常少量的DNA的超高通量分析。最主要的MALDI-TOFMS平台是Sequenom的MassArray 基因分型系统。
忠告
一次基因分型分析所能够检测的遗传突变的数量正在快速增长,比如能进行全基因组联合研究的微点隈杂交(Hybridization to microarrays)。虽然实验过程比较简单,但对于有多个旁系同源体的基因或相关的假基因,不能简单地相信自动分析仪或者微列阵得到的结果。研究它们的突变,首先要对这些片段进行选择性扩增和基因分型,基因的数量无关紧要,而且,单核苷酸多态性只代表了基因组突变的80%。还有要牢记一点:全基因组相关性研究并不是检测全基因组。
-
招标采购

-
焦点事件

-
科技前沿
-
综述
-
会议会展

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
技术原理
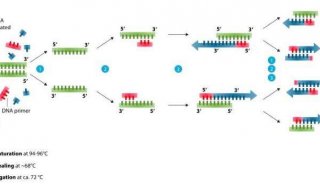
-
技术原理
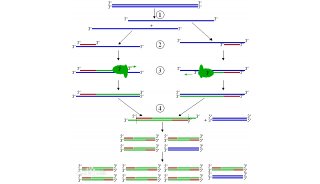
-
综述
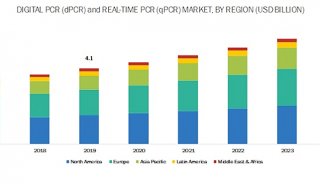
-
技术原理
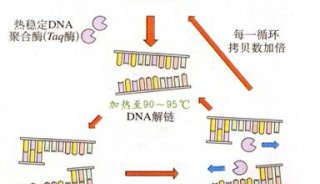
-
焦点事件

-
焦点事件

-
焦点事件