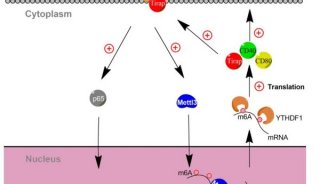
突破限制,集成高维技术发现DC细胞新亚型
树突状细胞(Dendritic cells,DCs)是目前所知的功能最强大的专职抗原呈递细胞,有两个主要细胞系:浆细胞样树突状细胞(plasmacytoid DCs,pDC)和常规树突状细胞(conventional DCs,cDC)。功能专门化的cDC又分为两个细胞系:cDC1和cDC2,这两种细胞的起源和分化途径目前仍不明朗。
由于DC是健康和疾病免疫反应的重要调控者,为了有针对性地制定它们的干预策略,人们需要深入了解它们的起源、功能特性和调控它们稳态的机制。因此,新加坡免疫学信息网的Peter See和Florent Ginhoux等人联合其他机构,采用两种无偏差高维技术(unbiased high-dimensional technologies)表征了人类从骨髓到血液中的DC细胞谱。
研究人员首先将包含DC细胞群的HLA−DR+CD135+细胞(Lineage−HLA−DR+CD135+ cells)从人血中分离出来。然后,用大规模并行单细胞mRNA测序鉴定了710个独立细胞的转录组。
结合互补生物学方法,研究人员发现了其中一小群细胞是一般水平认为的DC前体细胞(pre-DC)。在实验上,采用飞行时间流式细胞术在单细胞水平上,测量了Lineage−HLA−DR+细胞们中38种不同蛋白质的表达,发现pre-DC拥有CD123+CD33+CD45RA+表型,证明了这一小群细胞的与众不同。接下来,研究人员在体外鉴定了pre-DC能分化成cDC1和cDC2而不是pDC的能力。
但是令人意外的是,pre-DC也表达pDC的经典标志,例如CD123、CD303和CD304。证明,之前利用了这些分子标志鉴定或分离pDC的实验和研究都无意中包括了CD123+CD33+ pre-DC。今后,科研人员将如何准确地把pre-DC从pDC之中分离出来呢?
本篇《Science》文章提供了一些新的分子标记包括CD33、CX3CR1、CD2、CD5和CD327。
当研究人员利用这些分子标记将CD123+CD33+ pre-DC从CD123+CD33− pDC中分离出来后,竟发现了pre-DC与众不同的独特功能特性,而在以前,这些特点都属于pDC。
尽管pDC有一些“有益”功能,如生产α干扰素和白细胞介素(据报道),刺激CD4 T细胞等。但是,此项研究发现,pDC还有一个“坏”功能——毒害pre-DC。
科学家们还怀疑,pre-DC是否同时含有符合分化的和不符合分化的pre-cDC1和pre-cDC2前体细胞。利用微流控单细胞测序(microfluidic single-cell mRNA sequencing,scmRNAseq),研究人员发现,人类pre-DC细胞群中有一些细胞表现为cDC1和cDC2谱系的转录组启动。流式细胞术和体外DC分化实验进一步地鉴定了CD123+CADM1−CD1c一般认定的不符合分化的pre-DC,和能够分化的CADM1+CD1c−pre-cDC1和CADM1−CD1c+ pre-cDC2前体细胞。
最后,研究人员发现pre-cDC的子集具有像成熟DC细胞一样的表达T细胞共刺激分子,诱导幼稚CD4 T细胞类增殖和极化的功能。但是,暴露在Toll样受体9(Toll-like receptor 9,TLR9)配体CpG引发了早期pre-DC、pre-cDC1和pre-cDC2的IL-12p40和肿瘤坏死因子α的生产,相比之下,分化了的cDC1和cDC2并不表达TLR9。
文章指示出了DC不断分化的复杂谱系:从骨髓内的普通DC前体细胞(common DC progenitors,CDP)开始,在生成pre-DC和潜能pDC时发生分歧,在血液和脾脏最终双双成熟。pre-DC有着不同功能和表型的亚型,包括早期不符合分化的中立CD123+ pre-DC子集,和两个符合分化的CD45RA+CD123lo子集。具独立功能的多子集的pre-DC鉴定,为DC亚型特异性靶标治疗开拓了新途径。
-
项目成果

-
焦点事件

-
企业风采

-
项目成果
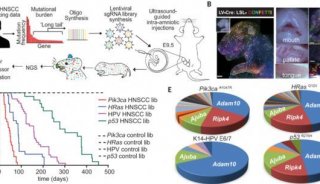
-
科技前沿
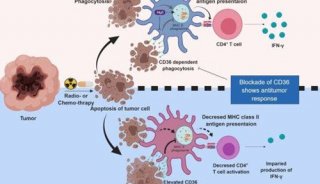
-
焦点事件